题目内容
在离子晶体中,阴、阳离子按一定规律在空间排列,如图左图所示为NaCl的晶体结构图。在离子晶体中,阴、阳离子具有或接近具有球对称的电子云,它们可以被看成是不等径的刚性圆球,并彼此相切(如图所示)。离子键的键长是相邻阴、阳离子的半径之和,已知a为常数。

试回答下列问题。
(1)在NaCl晶体中,每个Na+同时吸引_____个Cl-,而Na+数目与Cl-数目之比为_____。
(2)NaCl晶体离子键的键长为_____。
(3)Na+半径与Cl-半径之比r(Na+)/r(Cl-)=_______。
(已知: = 1.414,
= 1.414,  =1.732,
=1.732, 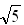 =2.236)
=2.236)
(4)NaCl中晶体不存在分子,但在温度达到1 413℃时,NaCl晶体形成气体,并以分子形式存在。现有29.25g NaCl晶体,加强热使温度达到1 450℃,测得气体体积为5.6 L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为__________。
(1)在NaCl晶体中,每个Na+同时吸引_____个Cl-,而Na+数目与Cl-数目之比为_____。
(2)NaCl晶体离子键的键长为_____。
(3)Na+半径与Cl-半径之比r(Na+)/r(Cl-)=_______。
(已知:
 = 1.414,
= 1.414,  =1.732,
=1.732, 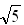 =2.236)
=2.236) (4)NaCl中晶体不存在分子,但在温度达到1 413℃时,NaCl晶体形成气体,并以分子形式存在。现有29.25g NaCl晶体,加强热使温度达到1 450℃,测得气体体积为5.6 L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为__________。
(1)6;1:1
(2)a/2
(3)0.414
(4)Na2Cl2

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【化学--化学与技术】
海洋是一座巨大的宝藏,海洋资源的开发与利用具有广阔的前景.某地海水的pH在7.5~8.6之间,其中主要离子的含量如下表:
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1.其中阴 (阳)离子交换膜只允许阴(阳)离子通过.
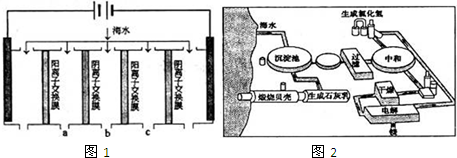
①阴极的电极反应式为 .
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式 .
③淡水的出口为a、b、c中的 出口.
(2)如图2是工业上生产镁的流程.
①干燥步骤中将氯化镁的水合晶体转化为无水氯化镁的操作方法是 .
②整个生产流程中,循环使用的物质是 .
③有人认为:过滤步骤后,直接加热Mg(OH)2得MgO,再电解熔融的MgO制金属镁,这样可优化生产过程.你的观点是 (填“同意”或“不同意”);理由是 .
海洋是一座巨大的宝藏,海洋资源的开发与利用具有广阔的前景.某地海水的pH在7.5~8.6之间,其中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO 42- | HCO 3+ | 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

①阴极的电极反应式为
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
③淡水的出口为a、b、c中的
(2)如图2是工业上生产镁的流程.
①干燥步骤中将氯化镁的水合晶体转化为无水氯化镁的操作方法是
②整个生产流程中,循环使用的物质是
③有人认为:过滤步骤后,直接加热Mg(OH)2得MgO,再电解熔融的MgO制金属镁,这样可优化生产过程.你的观点是
(12分)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
|
成分 |
含量/(mg L-1) |
成分 |
含量/(mg L-1) |
|
Cl- |
18980 |
Ca2+ |
400 |
|
Na+ |
10560 |
HCO3- |
142 |
|
SO42- |
2560 |
Br- |
64 |
|
Mg2+ |
1272 |
|
|
(1)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。

①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:

①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离
子方程式是 。用平衡移动原理解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解)。