题目内容
【化学--化学与技术】海洋是一座巨大的宝藏,海洋资源的开发与利用具有广阔的前景.某地海水的pH在7.5~8.6之间,其中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO 42- | HCO 3+ | 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
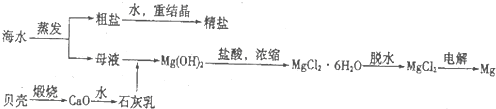
①阴极的电极反应式为
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
③淡水的出口为a、b、c中的
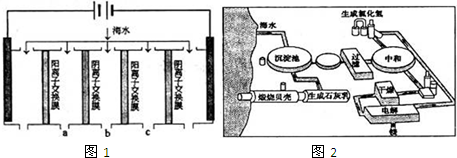
(2)如图2是工业上生产镁的流程.
①干燥步骤中将氯化镁的水合晶体转化为无水氯化镁的操作方法是
②整个生产流程中,循环使用的物质是
③有人认为:过滤步骤后,直接加热Mg(OH)2得MgO,再电解熔融的MgO制金属镁,这样可优化生产过程.你的观点是
分析:(1)①依据电渗析法淡化海水示意图分析,阴(阳)离子交换膜仅允许阴(阳)离子通过.所以阴极上是阳离子得到电子发生还原反应;
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;
(2)①氯化镁中的镁离子易水解,在酸性环境下可以抑制水解;
②根据流程图可以看出,氯气可以循环利用;
③根据氧化镁和氯化镁的熔点不同.
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,所以水在b处流出;
(2)①氯化镁中的镁离子易水解,在酸性环境下可以抑制水解;
②根据流程图可以看出,氯气可以循环利用;
③根据氧化镁和氯化镁的熔点不同.
解答:解:(1)①阴极上是阳离子得到电子发生还原反应,氢离子放电能力大于钠离子,所以电极反应为:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑,
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙,生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:Ca2++OH-+HCO3-=CaCO3↓+H2O;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,通过用一段时间海水中的 阴阳离子在两个电极放电,所以水在b处流出,
故答案为:b;
(2)①氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,得到无水MgCl2,
故答案为:在干燥的HCl气流中加热氯化镁晶体,以防止氯化镁水解;
②根据流程图可以看出,氯气可以循环利用;
故答案为:氯气;
③MgO熔点为3105℃,MgCl2熔点714℃,熔融MgO时耗费大量的能量,而增加生产成本,
故答案为:不同意;MgO熔点很高,熔融时耗费大量的能量而增加生产成本.
故答案为:2H++2e-=H2↑,
②阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,海水中含有碳酸氢根离子、钙离子,氢氧根离子和碳酸氢根离子反应生成碳酸根离子与钙离子生成白色沉淀碳酸钙,生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:Ca2++OH-+HCO3-=CaCO3↓+H2O;
③在电渗析法淡化海水示意图中阴离子移向阳极,阳离子移向阴极,通过用一段时间海水中的 阴阳离子在两个电极放电,所以水在b处流出,
故答案为:b;
(2)①氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,得到无水MgCl2,
故答案为:在干燥的HCl气流中加热氯化镁晶体,以防止氯化镁水解;
②根据流程图可以看出,氯气可以循环利用;
故答案为:氯气;
③MgO熔点为3105℃,MgCl2熔点714℃,熔融MgO时耗费大量的能量,而增加生产成本,
故答案为:不同意;MgO熔点很高,熔融时耗费大量的能量而增加生产成本.
点评:本题考查了海水淡化的电渗析原理的分析判断,海水中镁的提取过程,题目难度中等,掌握原理即可解答.

练习册系列答案
相关题目