题目内容
5.实现下列变化,需克服相同类型作用力的是( )| A. | 石墨和氯化钠分别受热熔化 | B. | 冰的融化和水的分解 | ||
| C. | NaCl和HCl溶于水 | D. | 干冰和碘的升华 |
分析 首先判断晶体的类型以及粒子间作用力类型,分子晶体中存在分子间作用力,离子晶体中存在离子键,原子晶体中存在共价键,金属晶体中存在金属键,根据晶体类型分析解答.
解答 解:A.石墨是混合晶体,熔化时破坏共价键和分子间作用力,氯化钠是离子晶体,熔化时破坏离子键,故A错误;
B.冰熔化主要破坏氢键,水分解破坏共价键,故B错误;
C.NaCl溶于水破坏离子键,HCl溶于水破坏共价键,故C错误;
D.干冰和碘都是分子晶体,干冰和碘的升华破坏分子间作用力,故D正确;
故选D.
点评 本题考查晶体的类型和微粒间作用力的判断,题目难度不大,注意物质发生变化时粒子间作用力的变化.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
16.下列有关物质分类或归纳的说法中,正确的一组是( )
①蔗糖和麦芽糖的化学式都可用C12H22O11表示,它们互为同分异构体
②聚乙烯,聚氯乙烯,纤维素都属于合成高分子
③盐酸,漂白粉,天然油脂都是混合物
④分馏,干馏,裂化都是化学变化
⑤植物油,裂化汽油都可与溴水反应.
①蔗糖和麦芽糖的化学式都可用C12H22O11表示,它们互为同分异构体
②聚乙烯,聚氯乙烯,纤维素都属于合成高分子
③盐酸,漂白粉,天然油脂都是混合物
④分馏,干馏,裂化都是化学变化
⑤植物油,裂化汽油都可与溴水反应.
| A. | ①③⑤ | B. | ②③④ | C. | ①③④ | D. | ②④⑤ |
13.工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气.对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用.
Ⅰ.脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是de.
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.

(2)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
①达到平衡时,反应I、II对比:平衡常数K(I)<K(II)(填“>”、“<”或“=”下同);平衡时CH3OH的浓度c(I)<c(II).
②对反应I,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).
若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
Ⅰ.脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是de.
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.

(2)改变温度,使反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应I,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).
若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
20.下列说法正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温条件下一定能够发生 | |
| C. | 反应物和生成物所具有的总能量的差决定了化学反应是放热还是吸热 | |
| D. | 化学反应才有伴随能量变化,物理变化没有伴随能量变化 |
10.铜锌原电池(如图)工作时,下列叙述不正确的是( )


| A. | 负极反应为:Zn-2e-═Zn2+ | B. | 电池反应为:Zn+Cu2+═Zn2++Cu | ||
| C. | 在外电路中,电子从负极流向正极 | D. | 盐桥中的K+移向ZnSO4溶液 |
17.下列物质中,不能与SiO2反应的是( )
| A. | NaOH | B. | CaO | C. | 氢氟酸 | D. | H2O |
14.下列物质中,摩尔质量最大的是( )
| A. | 10mL H2O | B. | 0.8mol H2SO4 | C. | 54g Al | D. | 1gCaCO3 |
15.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 3.1g由白磷和红磷组成的混合物中含有磷原子的数目为0.1NA | |
| B. | 0.1mol丙烯醛中含有双键的数目为0.1NA | |
| C. | 标准状况下,2.24L乙醇中含有的分子数目为0.1NA | |
| D. | 0.1mol的氯气全部溶于水后转移电子的数目为0.1NA |
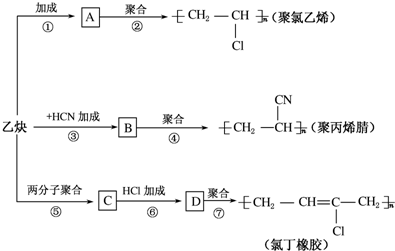

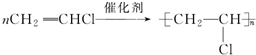 ;
;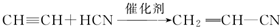 ;
;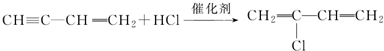 .
.