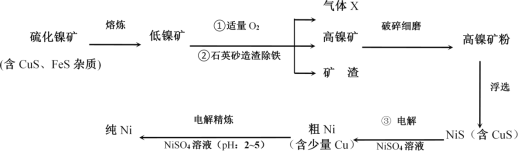
ЬтФПФкШн
ЁОЬтФПЁПЛКЪЭВМТхЗвЃЈМДMЃК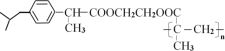 ЃЉЪЧГЃгУгкНтШШеђЭДвЉЮяЁЃMЕФвЛжжКЯГЩТЗЯпШчЭМЃК
ЃЉЪЧГЃгУгкНтШШеђЭДвЉЮяЁЃMЕФвЛжжКЯГЩТЗЯпШчЭМЃК
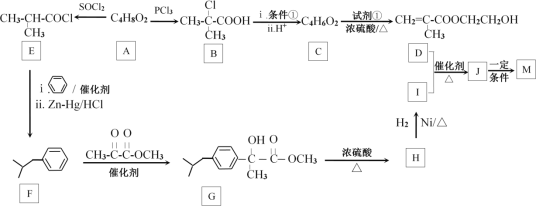
вбжЊЃКRCOORЁф+RЁхOH![]() RCOORЁх+RЁфOH
RCOORЁх+RЁфOH
ЧыАДвЊЧѓЛиД№ЯТСаЮЪЬтЃК
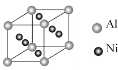
ЂХAЯЕЭГУќУћЕФУћГЦЃК__ЃЛЗДгІЬѕМўЂйЮЊ__ЃЛCЫљКЌЙйФмЭХЕФНсЙЙМђЪНЃК__ЃЛЪдМСЕФЗжзгЪНЃК__ЃЛJЁњMЗДгІРраЭЃК__ЁЃ
ЂЦAЕФЭЌЗжвьЙЙЬхгаЖржжЃЌЦфжаФмЗЂЩњвјОЕЗДгІЧвКЌгаєЧЛљЕФга_жжЃЛаДГіЦфжаКЫДХЙВеёЧтЦзга3зщЗхЃЌЗхУцЛ§жЎБШЮЊ6ЃК1ЃК1ЕФНсЙЙМђЪН__ЁЃ
ЂЧаДГіD+IЁњJЗДгІЕФЛЏбЇЗНГЬЪНЃК__ЁЃ
ЂШвдБНЁЂ![]() ЁЂБћЭЊЫсМзѕЅЃЈ
ЁЂБћЭЊЫсМзѕЅЃЈ![]() ЃЉЮЊЦ№ЪМдСЯжЦБИгаЛњЮяNЃЈ
ЃЉЮЊЦ№ЪМдСЯжЦБИгаЛњЮяNЃЈ![]() ЃЉЃЌаДГіNЕФКЯГЩТЗЯп___ЃЈЦфЫћЪдМСШЮбЁЃЌКЯГЩТЗЯпЪОР§МћЬтИЩЃЌгаЛњЮяОљаДНсЙЙМђЪНЃЉЁЃ
ЃЉЃЌаДГіNЕФКЯГЩТЗЯп___ЃЈЦфЫћЪдМСШЮбЁЃЌКЯГЩТЗЯпЪОР§МћЬтИЩЃЌгаЛњЮяОљаДНсЙЙМђЪНЃЉЁЃ

ЁОД№АИЁП2-МзЛљБћЫс(ЛђМзЛљБћЫс) NaOHввДМШмвКМгШШ ![]() ЁЂЁЊCOOH C2H6O2 МгОлЗДгІ 5
ЁЂЁЊCOOH C2H6O2 МгОлЗДгІ 5 ![]()
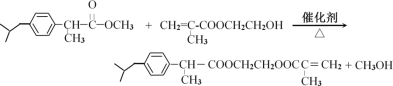
ЁОНтЮіЁП
ИљОнBЕФНсЙЙКЭAЕНBЪЧШЁДњЗДгІЕУГіAЕФНсЙЙМђЪНЮЊ![]() ЃЌИљОнКѓУцаХЯЂЕУЕНBЗЂЩњЯћШЅЗДгІЃЌЫсЛЏЕУЕНC(
ЃЌИљОнКѓУцаХЯЂЕУЕНBЗЂЩњЯћШЅЗДгІЃЌЫсЛЏЕУЕНC(![]() )ЃЌAЕНEЗЂЩњШЁДњЗДгІЩњГЩE(
)ЃЌAЕНEЗЂЩњШЁДњЗДгІЩњГЩE(![]() )ЃЌEКЭБНЛЗЁЂZn-Hg/HClЃЌдкДпЛЏМСЗЂЩњЗДгІЩњГЩFЃЌFКЭ
)ЃЌEКЭБНЛЗЁЂZn-Hg/HClЃЌдкДпЛЏМСЗЂЩњЗДгІЩњГЩFЃЌFКЭ![]() ЗЂЩњМгГЩЗДгІЩњГЩ
ЗЂЩњМгГЩЗДгІЩњГЩ![]() ЃЌ
ЃЌ![]() дкХЈСђЫсзїгУЯТЗЂЩњЯћШЅЗДгІЕУЕНHЃЌHдкДпЛЏМСзїгУЯТЗЂЩњМгГЩЗДгІЕУЕНI(
дкХЈСђЫсзїгУЯТЗЂЩњЯћШЅЗДгІЕУЕНHЃЌHдкДпЛЏМСзїгУЯТЗЂЩњМгГЩЗДгІЕУЕНI(![]() )ЃЌIКЭ
)ЃЌIКЭ![]() ЗЂЩњШЁДњЗДгІЩњГЩJЃЌJЗЂЩњМгОлЗДгІЕУЕНMЁЃ
ЗЂЩњШЁДњЗДгІЩњГЩJЃЌJЗЂЩњМгОлЗДгІЕУЕНMЁЃ
ЂХA(![]() )ЯЕЭГУќУћЕФУћГЦЃК2-МзЛљБћЫс(ЛђМзЛљБћЫс)ЃЛЗДгІЬѕМўЂйЪЧЗЂЩњЯћШЅЗДгІЃЌвђДЫЗДгІЬѕМўЮЊNaOHввДМШмвКМгШШЃЛCЫљКЌЙйФмЭХЮЊЬМЬМЫЋМќКЭєШЛљЃЌЦфЙйФмЭХЕФНсЙЙМђЪНЃК
)ЯЕЭГУќУћЕФУћГЦЃК2-МзЛљБћЫс(ЛђМзЛљБћЫс)ЃЛЗДгІЬѕМўЂйЪЧЗЂЩњЯћШЅЗДгІЃЌвђДЫЗДгІЬѕМўЮЊNaOHввДМШмвКМгШШЃЛCЫљКЌЙйФмЭХЮЊЬМЬМЫЋМќКЭєШЛљЃЌЦфЙйФмЭХЕФНсЙЙМђЪНЃК![]() ЁЂЁЊCOOHЃЛЪдМСЪЧввЖўДМЃЌЦфЗжзгЪНЃКC2H6O2ЃЛИљОнMЕФНсЙЙМђЪНЕУJЁњMЗДгІРраЭЃКМгОлЗДгІЃЛЙЪД№АИЮЊЃК2-МзЛљБћЫс(ЛђМзЛљБћЫс)ЃЛNaOHввДМШмвКМгШШЃЛ
ЁЂЁЊCOOHЃЛЪдМСЪЧввЖўДМЃЌЦфЗжзгЪНЃКC2H6O2ЃЛИљОнMЕФНсЙЙМђЪНЕУJЁњMЗДгІРраЭЃКМгОлЗДгІЃЛЙЪД№АИЮЊЃК2-МзЛљБћЫс(ЛђМзЛљБћЫс)ЃЛNaOHввДМШмвКМгШШЃЛ![]() ЁЂЁЊCOOHЃЛC2H6O2ЃЛМгОлЗДгІЁЃ
ЁЂЁЊCOOHЃЛC2H6O2ЃЛМгОлЗДгІЁЃ
ЂЦAЕФЭЌЗжвьЙЙЬхгаЖржжЃЌЦфжаФмЗЂЩњвјОЕЗДгІЧвКЌгаєЧЛљЃЌЫЕУїКЌгаЁЊCHOКЭЁЊOHЃЌЛЙгаШ§ИіЬМдзгЃЌСНИіШЁДњЛљЭХдкЭЌвЛИіЬМдзгЩЯгаСНжжЃЌдкВЛЭЌЬМдзгЩЯгаШ§жжНсЙЙЃЌЙВга5жжЃЛЦфжаКЫДХЙВеёЧтЦзга3зщЗхЃЌЗхУцЛ§жЎБШЮЊ6ЃК1ЃК1ЕФНсЙЙМђЪН![]() ЃЛЙЪД№АИЮЊЃК5ЃЛ
ЃЛЙЪД№АИЮЊЃК5ЃЛ![]() ЁЃ
ЁЃ
ЂЧD+IЁњJЗДгІЪЧШЁДњЗДгІЃЌЦфЛЏбЇЗНГЬЪНЃК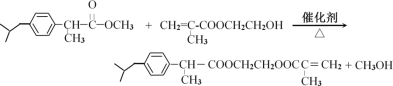 ЃЛЙЪД№АИЮЊЃК
ЃЛЙЪД№АИЮЊЃК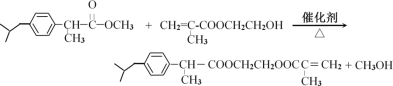 ЁЃ
ЁЃ
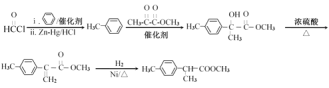
ЂШ![]() гыБНЛЗЃЌдкZn-Hg/HClДпЛЏМСЗЂЩњЗДгІЩњГЩ
гыБНЛЗЃЌдкZn-Hg/HClДпЛЏМСЗЂЩњЗДгІЩњГЩ![]() ЃЌ
ЃЌ![]() КЭ
КЭ![]() дкДпЛЏМСзїгУЯТЗДгІЩњГЩ
дкДпЛЏМСзїгУЯТЗДгІЩњГЩ![]() ЃЌ
ЃЌ![]() дкХЈСђЫсзїгУЯТМгШШЩњГЩ
дкХЈСђЫсзїгУЯТМгШШЩњГЩ![]() ЃЌ
ЃЌ![]() гыЧтЦјЗЂЩњМгГЩЗДгІЩњГЩ
гыЧтЦјЗЂЩњМгГЩЗДгІЩњГЩ![]() ЃЌЦфКЯГЩТЗЯпЮЊЃК
ЃЌЦфКЯГЩТЗЯпЮЊЃК ЃЛЙЪД№АИЮЊЃК
ЃЛЙЪД№АИЮЊЃК ЁЃ
ЁЃ

 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИЁОЬтФПЁПЭЕФЛЏКЯЮядкЙЄХЉвЕЩњВњжаОпгаживЊЕиЮЛЁЃЧыАДвЊЧѓЛиД№ЯТСаЮЪЬтЁЃ
Ђё.ФЩУзМЖCu2OгЩгкОпгагХСМЕФДпЛЏадФмЖјЪмЕНЙизЂЃЌЯТБэЮЊжЦШЁCu2OЕФШ§жжЗНЗЈЃК
ЗНЗЈa | гУЦЯЬбЬЧЛЙдаТжЦЕФCu(OH)2(NaOHЙ§СП)жЦБИCu2O |
ЗНЗЈb | гУыТ(N2H4)МгШШЛЙдаТжЦЕФCu(OH)2жЦБИCu2OЃЌЭЌЪБЗХГіN2 |
ЗНЗЈc | гУЬПЗлдк1000ЁцвдЩЯЛЙдCuOжЦБИCu2OЃЌЭЌЪБЗХГіCO |
(1)аДГіЗНЗЈaЕФЛЏбЇЗНГЬЪНЃК__ЁЃ
(2)вбжЊЃКЂй2Cu(s)+![]() O2(g)=Cu2O(s) ЁїH=-169kJЁЄmolЉ1
O2(g)=Cu2O(s) ЁїH=-169kJЁЄmolЉ1
ЂкC(s)+![]() O2(g)=CO(g) ЁїH=-110.5kJЁЄmolЉ1
O2(g)=CO(g) ЁїH=-110.5kJЁЄmolЉ1
ЂлCuO(s)=Cu(s)+![]() O2(g) ЁїH=+157kJЁЄmolЉ1
O2(g) ЁїH=+157kJЁЄmolЉ1
аДГіЗНЗЈcЗДгІЕФШШЛЏбЇЗНГЬЪНЃК__ЁЃ
(3)дкЯрЭЌЕФУмБеШнЦїжаЃЌгУЩЯБэЗНЗЈжЦЕУЕФШ§жжCu2OЗжБ№НјааДпЛЏЗжНтЫЎЕФЪЕбщЃК2H2O(g)![]() 2H2(g)+O2(g) ЁїHЃО0ЁЃЫЎеєЦјЕФХЈЖШЫцЪБМфtБфЛЏШчЯТБэЫљЪОЃК
2H2(g)+O2(g) ЁїHЃО0ЁЃЫЎеєЦјЕФХЈЖШЫцЪБМфtБфЛЏШчЯТБэЫљЪОЃК
ађКХ | 0 | 10 | 20 | 30 | 40 | 50 | |
i | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 | ii | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
iii | T2 | 0.100 | 0.0960 | 0.0930 | 0.0900 | 0.0900 | 0.0900 |
ЖдБШЩЯЪіЪЕбщЪ§ОнЃЌПЩЛёЕУЕФНсТлЃК
ЂйДпЛЏМСЕФДпЛЏаЇТЪЃКЪЕбщi___ЪЕбщii(ЬюЁА>ЁБЁА<ЁБЁА=ЁБЃЌЯТЭЌ)ЁЃ
ЂкT1__T2ЁЃ
Ђђ.дк2LЕФКуЮТУмБеШнЦїжаЭЈШы5molO2ВЂМгШызуСПCu2SЗЂЩњЗДгІЃКCu2S(s)+O2(g)=2Cu(s)+SO2(g) ЁїH1=-271.4kJ/molЃЌ
ЗДгІЙ§ГЬжаФГЦјЬхЕФЬхЛ§ЗжЪ§ЫцЪБМфБфЛЏШчЭМЫљЪОЁЃ
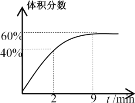
(4)ЗДгІЧА2minЦНОљЗДгІЫйТЪv(SO2)=__ЃЛИУЮТЖШЯТЗДгІЕФЦНКтГЃЪ§K=__ЁЃ
ШєБЃГжЮТЖШВЛБфЯђЦНКтЬхЯЕжадйЭЈШы1molO2ЃЌДяЕНаТЦНКтКѓбѕЦјЕФЬхЛ§ЗжЪ§__(ЬюЁАДѓгкЁБЁАаЁгкЁБЛђЁАЕШгкЁБ)дЦНКтЪБбѕЦјЕФЬхЛ§ЗжЪ§ЁЃ
ЁОЬтФПЁПФГЭЌбЇбаОПХЈЖШЖдЛЏбЇЦНКтЕФгАЯьЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
вбжЊЃКCr2O72-(aq)(ГШЩЋ)+H2O(l) | |
ВНжшЃК ЁЁЁЁЁЁЁЁ | ЯжЯѓЃК Д§ЪдЙмbжабеЩЋВЛБфКѓгыЪдЙмaБШНЯЃЌ ШмвКбеЩЋБфЧГЁЃ ЕЮМгХЈСђЫсЃЌЪдЙмcЮТЖШТдгаЩ§ИпЃЌ ШмвКбеЩЋгыЪдЙмaЯрБШЃЌБфЩюЁЃ |
A. ИУЗДгІЪЧвЛИібѕЛЏЛЙдЗДгІ
B. Д§ЪдЙмbжаШмвКбеЩЋВЛБфЕФФПЕФЪЧЪЙCr2O72-ЭъШЋЗДгІ
C. ИУЪЕбщВЛФмжЄУїМѕаЁЩњГЩЮяХЈЖШЃЌЦНКте§ЯђвЦЖЏ
D. ЪдЙмcжаЕФЯжЯѓЫЕУїгАЯьЦНКтЕФжївЊвђЫиЪЧЮТЖШ
ЁОЬтФПЁПЭЈГЃШЫУЧАбВ№ПЊ1mol ФГЛЏбЇМќЫљЮќЪеЕФФмСППДГЩИУЛЏбЇМќЕФМќФмЁЃМќФмЕФДѓаЁПЩгУгкЙРЫуЛЏбЇЗДгІЕФЗДгІШШ(ЁїH)ЁЃ
ЛЏбЇМќ | ClЃCl | HЁЊH | HЁЊCl | NЁдN |
МќФм/kJЁЄmol | 243 | 436 | 431 | 946 |
(1)АДвЊЧѓЭъГЩЬюПе
a.2HCl(g) ЃН H2(g)ЃЋCl2(g)ЃЛЁїH=______________________
b.N2 (g)+3H2(g)= 2NH3(g) ІЄH=-92kJ/molЃЌдђNЁЊHМќЕФМќФмЪЧ__________kJЁЄmol
(2)1 mol NO2КЭ1mol COЗДгІЩњГЩCO2КЭNOЙ§ГЬжаФмСПБфЛЏЪОвтЭМЃЌЧыаДГіNO2КЭCOЗДгІЕФШШЛЏбЇЗНГЬЪН__________________________________

(3) вбжЊдкГЃЮТГЃбЙЯТЃК
Ђй 2CH3OH(l) ЃЋ 3O2(g) ЃН 2CO2(g) ЃЋ 4H2O(g) ІЄH1
Ђк 2CO (g)+ O2(g) ЃН 2CO2(g) ІЄH2
Ђл H2O(g) ЃН H2O(l) ІЄH3
дђCH3OH(l)ЃЋO2(g)=CO(g)+ 2H2O(l)ІЄH =__________(гУКЌІЄH1ЁЂІЄH2ЁЂІЄH3ЕФЪНзгБэЪО)
(4)вбжЊЃК2Al (s)+ 3/2O2(g)==Al2O3(s) ЁїH=-1644.3 kJ mol-1
2Fe (s) +3/2O2(g)==Fe2O3(s) ЁїH=-815.88kJ mol-1
ЪдаДГіТСЗлгыбѕЛЏЬњЗлФЉЗЂЩњТСШШЗДгІЕФШШЛЏбЇЗНГЬЪН_______________________ЁЃ