题目内容
现有0.270Kg质量分数为20%、密度为1.35g/cm3的CuCl2溶液.计算:
(1)该溶液的体积;
(2)该溶液中的CuCl2物质的量;
(3)该溶液中的CuCl2物质的量浓度.
解:(1)该溶液的体积为V= =200ml,
=200ml,
答:该溶液的体积为200ml.
(2)该溶液中的CuCl2物质的量为n(CuCl2)= =0.4 mol,
=0.4 mol,
答:该溶液中的CuCl2物质的量为0.4mol.
(3)该溶液中的CuCl2物质的量浓度为c(CuCl2) =2mol/L.
=2mol/L.
答:该溶液中的CuCl2物质的量浓度为2mol/L.
分析:(1)溶液的体积等于溶液的质量除以溶液的密度;
(2)利用溶质的质量,除以溶质的摩尔质量可得物质的量;
(3)溶质的物质的量除以溶液的体积可得溶液的物质的量浓度.
点评:本题考查物质的量的有关计算,题目难度不大,本题注意把握有关计算公式的运用.
 =200ml,
=200ml,答:该溶液的体积为200ml.
(2)该溶液中的CuCl2物质的量为n(CuCl2)=
 =0.4 mol,
=0.4 mol,答:该溶液中的CuCl2物质的量为0.4mol.
(3)该溶液中的CuCl2物质的量浓度为c(CuCl2)
 =2mol/L.
=2mol/L.答:该溶液中的CuCl2物质的量浓度为2mol/L.
分析:(1)溶液的体积等于溶液的质量除以溶液的密度;
(2)利用溶质的质量,除以溶质的摩尔质量可得物质的量;
(3)溶质的物质的量除以溶液的体积可得溶液的物质的量浓度.
点评:本题考查物质的量的有关计算,题目难度不大,本题注意把握有关计算公式的运用.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
高锰酸钾是常用的氧化剂.以下是工业上用软锰矿制备高锰酸钾的一种工艺流程.
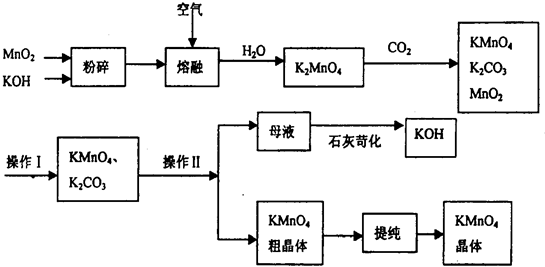
(1)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是______ (填序号)
a.浓硝酸 b.硝酸银 c.氯水 d.烧碱
(2)K2MnO4和C02反应生成KMnO4、MnO2和K2C03的化学方程式为:______
(3)上述流程中可循环使用的物质有______ (用化学式表示,至少写2种).
(4)操作I的名称是______;用结晶法分离KMnO4、K2C03两种物质,进行该操作前需查阅的资料是______.
(5)以下是KMnO4的溶解度数据.
| 温度(℃) | O | 10 | 20 | 50 | 60 |
| S(g/lOOg水) | 2.8 | 4.3 | 6.3 | 17.0 | 22.1 |
物质A~K都是由下表中离子组成的,且为中学化学常见物质,有下图所示的转化关系,部分产物中的水已省略.(如果需要阴、阳离子可以重复使用)
| 阳离子 | Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、SO2-4、AlO-2、NO-3 |

已知C、D、J都是白色沉淀,其中D、J不溶于稀硝酸.试按要求回答下列相关问题:
(1)A、D、K、J的化学式为:A______、D______、K______、J______;
(2)已知B溶液和E溶液都显碱性,则相同条件下,物质的量浓度相同的B溶液和E溶液pH较大的是______(用化学式表示);
(3)写出反应②的离子反应方程式______;
(4)用惰性电极电解I溶液阳极的电极反应式为______.
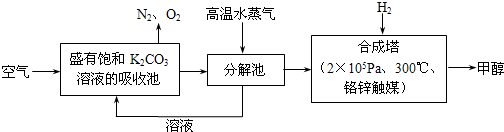
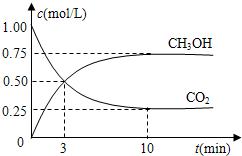
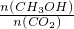 比值______(填“增大”、“减小”或“不变”).
比值______(填“增大”、“减小”或“不变”).
