题目内容
向100mL的FeBr2溶液中通入标准状况下C123.36L,所得溶液中C1一和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )
| A、0.75mol?L-1 |
| B、1 mol?L-1 |
| C、1.5 mol?L-1 |
| D、2 mol?L-1 |
考点:氧化还原反应的计算,离子方程式的有关计算
专题:计算题
分析:还原性Fe2+>Br-,通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-,反应后溶液中Cl-和Br-的物质的量浓度相等,说明氯气完全反应,Cl2的物质的量=
=0.15mol,若Br-没有反应,溶液中n(Br-)=0.3mol,则n(FeBr2)=0.15mol,0.15molFe2+只能消耗0.075mol的Cl2,故有部分Br-参加反应,设FeBr2的物质的量为x,表示出参加反应的n(Br-),根据电子转移守恒列方程计算x值,再根据c=
计算.
| 3.36L |
| 22.4L/mol |
| n |
| V |
解答:
解:还原性Fe2+>Br-,通入氯气先发生反应2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,剩余的氯气再发生反应2Br-+Cl2═Br2+2Cl-,反应后溶液中Cl-和Br-的物质的量浓度相等,说明氯气完全反应,Cl2的物质的量=
=0.15mol,若Br-没有反应,n(Br-)=0.3mol,则n(FeBr2)=0.15mol,0.15molFe2+只能消耗0.075mol的Cl2,故有部分Br-参加反应,
设FeBr2的物质的量为x,则n(Fe2+)=x mol,n(Br-)=2x mol,未反应的n(Br-)=0.3 mol,参加反应的n(Br-)=(2x-0.3)mol,根据电子转移守恒有x×1+[2x-0.3]×1=0.15mol×2,解得x=0.2 mol,所以原FeBr2溶液的物质的量浓度为
=2mol/L,
故选D.
| 3.36L |
| 22.4L/mol |
设FeBr2的物质的量为x,则n(Fe2+)=x mol,n(Br-)=2x mol,未反应的n(Br-)=0.3 mol,参加反应的n(Br-)=(2x-0.3)mol,根据电子转移守恒有x×1+[2x-0.3]×1=0.15mol×2,解得x=0.2 mol,所以原FeBr2溶液的物质的量浓度为
| 0.2mol |
| 0.1L |
故选D.
点评:本题考查氧化还原反应的计算,为高频考点,把握还原性的强弱及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
如图所示是分离混合物时常用的仪器,从左至右,可以进行的混合物分离操作分别是( )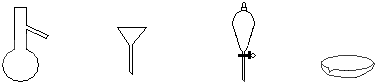
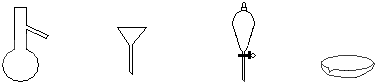
| A、蒸馏、蒸发、萃取、过滤 |
| B、过滤、蒸发、萃取、蒸馏 |
| C、萃取、过滤、蒸馏、蒸发 |
| D、蒸馏、过滤、萃取、蒸发 |
A、B、C都是有机化合物,且有如下转化关系:A
B
C,A的相对分子质量比B大2,C的相对分子量比B大16,C能与过量的NaOH反应生成一种常见的气体,以下说法正确的是( )
| 去氢 |
| 加氢 |
| 被氧气氧化 |
| 催化剂 |
| A、A是乙炔,B是乙烯 |
| B、A是乙醇,B是乙醛 |
| C、A是乙烯,B是乙烷 |
| D、A是环己烷,B是苯 |
能区别甲烷和乙烯两种气体的化学试剂是( )
| A、NaOH 溶液 |
| B、HCl |
| C、乙醇 |
| D、酸性高锰酸钾溶液 |
室温下,有关①100mL 0.1mol?L-1 NaHCO3、②100mL 0.1mol?L-1 Na2CO3两种溶液的叙述错误的是
( )
( )
| A、两溶液中水的电离度比较:②>① |
| B、分别加入少量NaOH固体,恢复到原温度,c(CO32-)均增大 |
| C、①溶液中:c(CO32-)<c(H2CO3) |
| D、②溶液中:c(HCO3-)<c(H2CO3) |
下列物质露置于干燥的空气中,不发生变化的是( )
| A、NaHCO3 |
| B、Na2O |
| C、Na2O2 |
| D、Na2CO3?10H2O |