题目内容
16. 可逆反应2A(g)+nB(g)?mC(g)在温度分别为T1、T2,压强分别为P1、P2的条件下,测得C的量与时间的关系如图. 根据图分析,P1、P2的大小关系为P2>P1;反应式中系数m和n的关系是2+n<m;该反应的逆反应是放热反应.
可逆反应2A(g)+nB(g)?mC(g)在温度分别为T1、T2,压强分别为P1、P2的条件下,测得C的量与时间的关系如图. 根据图分析,P1、P2的大小关系为P2>P1;反应式中系数m和n的关系是2+n<m;该反应的逆反应是放热反应.
分析 根据温度、压强对平衡移动的影响分析,温度越高、压强越大,则反应速率越大,达到平衡用的时间越少,曲线的斜率越大.
解答 解:相同压强下,根据温度对反应速率的影响可知,温度越高,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:T1>T2,升高温度,C的含量增大,平衡向正反应方向移动,则正反应为吸热反应;逆方向是放热的,相同温度下,根据压强对反应速率的影响可知,压强越大,反应速率越大,则达到平衡用的时间越少,曲线的斜率越大,故有:P2>P1,压强越大,生成物C的物质的量越小,说明平衡向逆反应方向移动,则反应前后混合气体的计量数增大,所以2+n<m,
故答案为:P2>P1;2+n<m;放.
点评 本题考查了温度、压强对化学平衡的影响,根据“先拐先平数值大”确定温度、压强的相对大小,再结合温度、压强与生成物D物质的量的变化确定反应热及气体的计量数变化,难度中等.

练习册系列答案
相关题目
4.HM和HR的溶液分别加水稀释时pH变化如图.下列叙述中正确的是( )
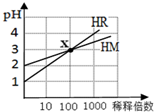

| A. | HR可能是弱酸 | B. | x点时c(R-)=c(M-) | ||
| C. | HM是一种强酸 | D. | 稀释前,c(HR)=10c(HM) |
6.假如12C相对原子质量为24,以0.024kg12C所含的12C原子数为阿伏加德罗常数(NA)则下列说法正确的是
( )
( )
| A. | 此时CO2的摩尔质量为88g.mol-1 | |
| B. | 标准状况下44gCO2体积约为11.2L | |
| C. | 44gCO2与28gCO含有相同数目的原子 | |
| D. | NA个O2大约为6.02×1023个 |
 此烃名称为3-甲基-2-丙基-1-戊烯.
此烃名称为3-甲基-2-丙基-1-戊烯.