题目内容
3. 医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
医疗上绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:Ⅰ.[制备产品]
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用如图所示装置制备FeSO4•7H2O晶体,步骤如下:
(1)预处理:先将废铁屑加入到饱和Na2CO3溶液中洗涤,目的是洗去铁屑表面的油污,然后将废铁屑用水洗涤2~3遍.
(2)将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入N2,N2的作用是排除装置中的空气或氧气.
(3)再加入足量稀硫酸,控制温度50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为Cu.
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤,冷却;结晶.滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干,密闭保存.
Ⅱ.[测定FeSO4•7H2O含量]
(1)称取上述样品10.0g,溶于适量的稀硫酸中,配成100mL溶液,需要的仪器除天平、玻璃棒、烧杯、量筒外,还需要的仪器有(填仪器名称)100mL 容量瓶、胶头滴管.
(2)准确量取25mL该液体于锥形瓶中,用0.1000mol/L KMnO4标准溶液滴定,则滴定终点的判断方法是当最后一滴标准液滴入时,溶液变为紫红色,且30s保持不变.
(3)用同样的方法滴定3次,平均消耗10.00mL标准液,该样品中FeSO4•7H2O的质量分数为55.6%.(已知Mr(FeSO4•7H2O)=278).
(4)若测量结果偏小,则可能是在定容时仰视(填“俯视”或“仰视”)读数.
分析 I.氧化铜、氧化铁与硫酸反应生成硫酸铜和硫酸铁,铁单质与硫酸铜和硫酸铁反应生成硫酸亚铁和铜单质.
(1)碳酸钠的水溶液显碱性,可以除去铁屑表面的油污;
(2)FeSO4易被氧气氧化;
(3)氧化铜、氧化铁与硫酸反应生成硫酸铜和硫酸铁,铁单质与硫酸铜和硫酸铁反应生成硫酸亚铁和铜单质;
(4)过滤,冷却结晶可得FeSO4•7H2O晶体;
II.(1)根据配制溶液的步骤以及每步操作需要仪器确定反应所需仪器;
(2)可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点;
(3)Fe2+→Fe3+,铁元素化合价升高1价;MnO4-→Mn2+,锰元素降低5价,化合价升降最小公倍数为5,根据关系式5Fe2+~MnO4-,计算25mL该液体中Fe2+的物质的量,进而计算样品中FeSO4•7H2O的质量,再根据质量分数定义计算;
(4)定容时仰视读取标准溶液体积偏大.
解答 解:I.(1)碳酸钠的水溶液显碱性,可以除去铁屑表面的油污,故答案为:洗去铁屑表面的油污;
(2)FeSO4易被氧气氧化,持续通入N2排除装置中的空气或氧气,故答案为:排除装置中的空气或氧气;
(3)氧化铜、氧化铁与硫酸反应生成硫酸铜和硫酸铁,铁单质与硫酸铜和硫酸铁反应生成硫酸亚铁和铜单质,故答案为:Cu;
(4)洗涤、过滤、冷却结晶可得FeSO4•7H2O晶体,故答案为:冷却;结晶;
II.(1)步骤为:计算→称量→溶液→转移→洗涤→定容→摇匀→装瓶→贴签,需要使用的仪器有:100mL 容量瓶,托盘天平、烧杯、玻璃棒、胶头滴管,量筒可用可不用,
故答案为:100mL 容量瓶;胶头滴管;
(2)可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KMnO4溶液时,溶液将由无色变为紫红色,
故答案为:当最后一滴标准液滴入时,溶液变为紫红色,且30s保持不变;
(3)测定样品中Fe2+的含量,采用在酸性条件下KMnO4标准液滴定,Fe2+→Fe3+,铁元素化合价升高1价;MnO4-→Mn2+,锰元素降低5价,化合价升降最小公倍数为5,故Fe2+系数为5,MnO4- 系数为1,根据元素守恒可知Mn2+与Fe3+系数分别为1、5,根据电荷守恒可知缺项为H+,H+其系数为2+3×5-[2×5-1]=8,根据H元素守恒可知H2O系数是4,所以反应离子方程式为5Fe2++MnO4-+8H+=1Mn2++5Fe3++4H2O,
令Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4-,
5 1
xmol 0.01L×0.1mol/L
所以x=$\frac{0.01×0.1mol/L×5}{1}$=0.005mol,
所以样品中FeSO4•7H2O的质量0.005mol×4×278g/mol=5.56g,所以4g产品中FeSO4•7H2O的质量分数为$\frac{5.56g}{10g}$×100%=55.6%,
故答案为:55.6%;
(4)定容时仰视体积偏大,浓度偏小,故答案为:仰视.
点评 本题考查物质的制备与含量的测定,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | Zn和稀硝酸反应 Zn+2H+═Zn2++H2↑ | |
| B. | 鸡蛋壳在醋酸中溶解有气泡产生:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 制备氢氧化铁胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| D. | Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O |
| A. | 石油分馏、煤的气化、煤的干馏、海水制盐等都属于化学变化过程 | |
| B. | 水泥、玻璃、陶瓷是人们在生产、生活中用量最大的无机非金属材料 | |
| C. | NO2、SO2、CO2、PM2.5都是空气质量日报必须报道的大气污染物 | |
| D. | 家用天然气含有特殊气味的主要原因是开采的天然气未经处理就直接转为民用燃气 |

| A. | 该反应是吸热反应 | |
| B. | 断裂2molA-B键需要吸收ykJ的能量 | |
| C. | 2molAB的总能量高于1molA2和1molB2的总能量 | |
| D. | 断裂1molA-A键和1molB-B键能放出xkJ的能量 |
| A. | 石蕊试剂滴入稀盐酸 | |
| B. | 酚酞试剂滴入氢氧化钠溶液 | |
| C. | 食盐溶液加水稀释 | |
| D. | 干燥的氯气通过刚采摘的红色的鲜花 |
| A. |  用图所示装置验证NaHCO3的不稳定性 用图所示装置验证NaHCO3的不稳定性 | |
| B. | 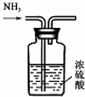 用图所示装置干燥氨气 用图所示装置干燥氨气 | |
| C. | 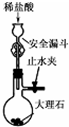 用图所示装置制取少量CO2气体 用图所示装置制取少量CO2气体 | |
| D. |  用图所示装置分馏石油 用图所示装置分馏石油 |

 一刚性容器内部有一个不漏气且可滑动的活塞将容器分成左右两个室,左室内充入一定体积的N2气体,右室充入A和B两种气体,且A和B的物质的量之比为3:2,右室内发生如下反应:3A(g)+2B(g)?C(g).反应开始前活塞停留在离左端1/4处(如图),反应在恒温下进行,当反应达平衡状态时,活塞处于容器中间.
一刚性容器内部有一个不漏气且可滑动的活塞将容器分成左右两个室,左室内充入一定体积的N2气体,右室充入A和B两种气体,且A和B的物质的量之比为3:2,右室内发生如下反应:3A(g)+2B(g)?C(g).反应开始前活塞停留在离左端1/4处(如图),反应在恒温下进行,当反应达平衡状态时,活塞处于容器中间.