题目内容
16.中国地质学家发现了一种新矿物,这种新矿物由X、Y、Z、W、R、T六种主族元素组成,其中X、Y、Z是金属元素,W、R、T是非金属元素.新矿物的化学式可表示为X3Y2(ZWR4)3T2;已知X和Z同主族,Y、Z、R、T同周期,T是非金属性最强的元素;Z原子的最外层电子数与次外层电子数相等,另外与R同主族的另一短周期表元素是Q,Q元素的最高氧化物对应水化物甲在工业上用途广泛,用途如图,X与R的原子序数之和是W的2倍.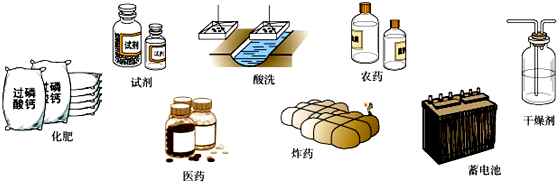
请回答下列问题
(1)W在元素周期表中的位置是第三周期IVA族.
(2)Y、Z、R、T四种同周期元素中原子半径最大的是Li(用元素符号表示,后同)
(3)写出这种新矿物的化学式:Ca3Li2(BeSiO4)3F2.
(4)写出由甲与XT2反应制T的氢化物的化学方程式CaF2+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CaSO4+2HF.
(5)在长途运输活鱼时,常在水中加入一定量的XR2,加入XR2的目的是杀菌消毒和提供氧气
(6)由短周期元素组成的某些粒子,如SO2、O3、NO可互称为等电子体,则与Z同周期元素组成的粒子中,能与N3-、CS2互称为等电子体的粒子是一氧化二氮、二氟化铍和二氧化碳(填符合要求粒子的名称).
分析 T为非金属性最强的元素,则T为F元素;Y、Z、R、T为同周期元素,即处于第二周期,Z原子的最外层电子数与次外层电子数相等,则Z为Be元素;Y为金属元素,则Y为Li;R原子的最外层电子数为次外层电子数的3倍,R为O元素;X、Z为同主族元素,则X为Mg元素或Ca元素,若X为Mg元素,则由X与R原子序数之和是W的2倍,W原子序数为$\frac{12+8}{2}$=10,为氖元素,不符合题意,若X为Ca元素,W原子序数为$\frac{20+8}{2}$=14,符合题意,即X为Ca元素、W为Si,根据分析Q为S,据此分析回答各个小题.
解答 解:T为非金属性最强的元素,则T为F元素;Y、Z、R、T为同周期元素,即处于第二周期,Z原子的最外层电子数与次外层电子数相等,则Z为Be元素;Y为金属元素,则Y为Li;R原子的最外层电子数为次外层电子数的3倍,R为O元素;X、Z为同主族元素,则X为Mg元素或Ca元素,若X为Mg元素,则由X与R原子序数之和是W的2倍,W原子序数为$\frac{12+8}{2}$=10,为氖元素,不符合题意,若X为Ca元素,W原子序数为$\frac{20+8}{2}$=14,符合题意,即X为Ca元素、W为Si,根据分析Q为S,
(1)W为硅,位于周期表第三周期IVA族,故答案为:第三周期IVA族;
(2)电子层数越多半径越大,相同电子层数,原子序数越小半径越大,Y、Z、R、T分被为Li、Be、O、F,故半径最大的为Li,故答案为:Li;
(3)根据上述分析,该矿物的化学式为Ca3Li2(BeSiO4)3F2,故答案为:Ca3Li2(BeSiO4)3F2;
(4)甲为硫酸,与XT2(CaF2)反应制HF的化学方程式为CaF2+H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CaSO4+2HF,故答案为:CaF2+H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CaSO4+2HF;(5)在长途运输活鱼时,常在水中加入一定量的CaO2,与水和二氧化碳反应产生氧气,其目的是作为杀菌消毒和供氧剂,故答案为:提供氧气;
(6)等电子体为原子数相等,价电子总数也相等的微粒,则与Be同周期元素组成的微粒中,能与N3-、CS2互称为等电子体的微粒是二氧化碳,故答案为:二氧化碳.
点评 本题考查位置结构性质关系及应用,关键是根据物质组成推断元素,由于考查的知识点较多,需要学生具备扎实的基础,注意等电子体概念的理解,题目难度中等.

| A. | 1 mol乙醇燃烧生成3 mol水 | |
| B. | 1 mol乙醇可以生成1 mol乙醛 | |
| C. | 1 mol乙醇跟足量的金属钠作用得0.5 mol氢气 | |
| D. | 乙醇的分子式为C2H6O |
| A. | 常温下,钠长期暴露在空气中生成白色的氧化钠固体 | |
| B. | 铁能与氯气发生反应,故不能用铁制容器贮存氯气 | |
| C. | 铜能与氯化铁溶液发生置换反应,该反应可以用于印刷电路板的制作 | |
| D. | 燃着的镁条伸入盛满氮气的集气瓶中能继续燃烧 |
| A. | 放电时,CH3OH参与反应的电极为正极 | |
| B. | 放电时,每通入标况下11.2L O2完全反应转移电子数为1mol | |
| C. | 放电时,电解质溶液的pH逐渐增大 | |
| D. | 放电时,负极反应为:CH3OH-6e-+8OH-=CO32-+6H2O |
 .
. .
.
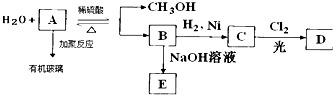
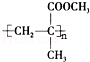 .
. CH3OH+CH2=C(CH3)COOH.
CH3OH+CH2=C(CH3)COOH.