题目内容
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1molL-1CH3COOH溶液中加入少量水,溶液中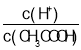 减小
减小
B.向0.1molL-1的氨水中加入少量硫酸铵固体,则溶液中![]() 增大
增大
C.向一定浓度的醋酸溶液中加水稀释,则溶液中 增大
增大
D.40℃时,在氨水体系中不断通入CO2,随着CO2的通入,![]() 不断增大
不断增大
【答案】B
【解析】
A.加水稀释促进醋酸电离但是醋酸电离增大程度小于溶液体积增大程度,所以溶液中![]() 减小,温度不变电离平衡常数不变,则溶液中
减小,温度不变电离平衡常数不变,则溶液中![]() 增大,故A错误;
增大,故A错误;
B.向氨水中加入少量硫酸铵,硫酸铵电离出![]() 而使溶液中
而使溶液中![]() 增大,抑制一水合氨电离,溶液碱性减弱,则溶液中
增大,抑制一水合氨电离,溶液碱性减弱,则溶液中![]() 减小,溶液中
减小,溶液中![]() 增大,故B正确;
增大,故B正确;
C.温度不变醋酸电离平衡常数不变,溶液中 不变,故C错误;
不变,故C错误;
D.在氨水体系中不断通入![]() ,随着
,随着![]() 的通入,二者反应生成碳酸铵,溶液中
的通入,二者反应生成碳酸铵,溶液中![]() 增大,
增大,![]() 减小,故D错误;
减小,故D错误;
答案选B。

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.008 mol·L-1
D. 反应开始时,乙中的反应速率最快,甲中的反应速率最慢




