题目内容
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式: C+ KMnO4+ H2SO4→ CO2↑+ MnSO4+ K2SO4+ H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验1条件下平衡常数K= (取小数二位,下同).
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值 (填具体值或取值范围).
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正 V逆(填“<”,“>”,“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(4)为最近有科学家提出构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.该构想技术流程如下:
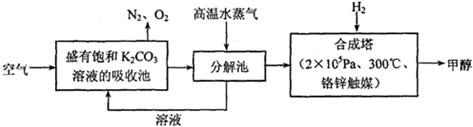
向分解池中通入高温水蒸气的作用是
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 .
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值
③实验4,若900℃时,在此容器中加入10molCO,5molH2O,2molCO2,5molH2,则此时V正
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(4)为最近有科学家提出构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.该构想技术流程如下:

向分解池中通入高温水蒸气的作用是
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
考点:化学平衡的计算,氧化还原反应方程式的配平,热化学方程式,难溶电解质的溶解平衡及沉淀转化的本质
专题:化学反应中的能量变化,化学平衡专题,电离平衡与溶液的pH专题
分析:(1)根据氧化还原反应氧化剂、还原剂得失电子数目相等配平;
(2)①平衡常数指生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比值,平衡常数k=
,
根据三段式求出各组分的物质的量的变化量,平衡时各组分的物质的量,由于各物质的系数为1,所以可用物质的量代替浓度代入平衡常数计算;
②由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2的转化率,则增大H2的物质的量;
③对同一反应温度相同,平衡常数相同.根据表中实验2计算900℃时平衡常数,再计算实验3浓度商,与平衡常数相比判断平衡移动,据此解答;
(3)根据盖斯定律解答;
(4)空气在二氧化碳再吸收池中转化为碳酸氢钾,合成塔内为氢气与二氧化碳反应合成甲醇,所以分解池应提供二氧化碳;
(5)根据Ksp(CaCO3)=c(CO32-)×c(Ca2+)计算.
(2)①平衡常数指生成物浓度的系数次幂之积与反应物浓度系数次幂之积的比值,平衡常数k=
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
根据三段式求出各组分的物质的量的变化量,平衡时各组分的物质的量,由于各物质的系数为1,所以可用物质的量代替浓度代入平衡常数计算;
②由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2的转化率,则增大H2的物质的量;
③对同一反应温度相同,平衡常数相同.根据表中实验2计算900℃时平衡常数,再计算实验3浓度商,与平衡常数相比判断平衡移动,据此解答;
(3)根据盖斯定律解答;
(4)空气在二氧化碳再吸收池中转化为碳酸氢钾,合成塔内为氢气与二氧化碳反应合成甲醇,所以分解池应提供二氧化碳;
(5)根据Ksp(CaCO3)=c(CO32-)×c(Ca2+)计算.
解答:
解:(1)反应中C元素化合价0→+4,Mn元素化合价+7→+2,反应得失电子相等,则有:5C~4KMnO4,根据质量守恒可确定H2SO4的计量数为6,则配平后的计量数分别是:5、4、6、5、4、2、6,故答案为:5;4;6;5;4;2;6;
(2)①对于反应 CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):4 2 0 0
变化(mol) 4-2.4=1.6 1.6 1.6 1.6
平衡(mol):2.4 2-1.6=0.4 1.6 1.6
所以650℃平衡常数平衡常数k=
=
=2.67,
故答案为:2.67;
②由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2的转化率,则增大H2的物质的量,即a/b 的值小于1,
故答案为:小于1;
③对同一反应温度相同,平衡常数相同.根据表中实验2计算900℃时平衡常数,
对于反应 CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):2-1.6=0.4 0.4 0.4 0.4
平衡(mol):1.6 1-0.4=0.6 0.4 0.4
900℃时平衡常数k=
=
=
,
实验3的浓度商为Qc=
=
,大于平衡常数,反应向逆反应进行,所以V正<V逆,
故答案为:<;
(3)已知热化学方程式:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol,
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,
③H2O(g)=H2O(l)△H=-44.0kJ/mol,
根据盖斯定律①-②+③×4,得2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l)△H=-885.6 kJ∕mol,
即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol;
(4)空气在二氧化碳再吸收池中转化为碳酸氢钾,合成塔内为氢气与二氧化碳反应合成甲醇,所以分解池应提供二氧化碳.向分解池中通入高温水蒸气的作用是提供高温环境使KHCO3分解,故答案为:提供高温环境使KHCO3分解;
(5)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后浓度为1×10-4mol/L,
由Ksp(CaCO3)=c(CO32-)×c(Ca2+)可知,混合后c(Ca2+)=
=
=2.8×10-5mol/L,
所以所需CaCl2溶液的最小浓度为2.8×10-5mol/L×2=5.6×10-5mol/L,
故答案为:5.6×10-5mol/L.
(2)①对于反应 CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):4 2 0 0
变化(mol) 4-2.4=1.6 1.6 1.6 1.6
平衡(mol):2.4 2-1.6=0.4 1.6 1.6
所以650℃平衡常数平衡常数k=
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| 1.6×1.6 |
| 2.4×0.4 |
故答案为:2.67;
②由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2的转化率,则增大H2的物质的量,即a/b 的值小于1,
故答案为:小于1;
③对同一反应温度相同,平衡常数相同.根据表中实验2计算900℃时平衡常数,
对于反应 CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):2-1.6=0.4 0.4 0.4 0.4
平衡(mol):1.6 1-0.4=0.6 0.4 0.4
900℃时平衡常数k=
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| 0.4×0.4 |
| 1.6×0.6 |
| 1 |
| 6 |
实验3的浓度商为Qc=
| 5×2 |
| 10×5 |
| 1 |
| 5 |
故答案为:<;
(3)已知热化学方程式:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol,
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,
③H2O(g)=H2O(l)△H=-44.0kJ/mol,
根据盖斯定律①-②+③×4,得2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l)△H=-885.6 kJ∕mol,
即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ∕mol;
(4)空气在二氧化碳再吸收池中转化为碳酸氢钾,合成塔内为氢气与二氧化碳反应合成甲醇,所以分解池应提供二氧化碳.向分解池中通入高温水蒸气的作用是提供高温环境使KHCO3分解,故答案为:提供高温环境使KHCO3分解;
(5)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后浓度为1×10-4mol/L,
由Ksp(CaCO3)=c(CO32-)×c(Ca2+)可知,混合后c(Ca2+)=
| Ksp(CaCO3) | ||
c(
|
| 2.8×10-9 |
| 1×10-4 |
所以所需CaCl2溶液的最小浓度为2.8×10-5mol/L×2=5.6×10-5mol/L,
故答案为:5.6×10-5mol/L.
点评:本题考查较为综合,涉及化学平衡、反应热、以及难溶电解质的溶解平衡等问题,题目难度较大,学习中注意相关解答方法的积累.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
某同学用25℃的水溶解一定量的NaCl,充分搅拌后发现杯底还有部分NaCl晶体没有溶解.然后该同学又用酒精灯加热至60C,固体全部溶解.那么在加热前后,以下各量没有发生改变的是( )
| A、NaCl的溶解度 |
| B、溶质的质量 |
| C、溶剂的质量 |
| D、溶质的质量分数 |
在下列物质中,其物质的量为0.2mol的是( )
| A、2.2gCO2 |
| B、3.6gH2O |
| C、3.2gO2 |
| D、4.9gH2SO4 |
下列属于物理变化的是( )
| A、炸药爆炸 | B、干冰升华 |
| C、蛋糕发霉 | D、葡萄酿酒 |
下列说法正确的是( )
| A、原子间没有间隔 |
| B、原子可构成分子,但不能直接构成物质 |
| C、原子是不能再分的最小微粒 |
| D、化学变化中原子的种类和个数都不变 |
 实验室需用98ml 1.0mol/L 硫酸,现用浓硫酸(标签如下图)配制.实验仪器有:A.25ml量筒 B.托盘天平 C.玻璃棒 D.50ml容量瓶 E.10ml量筒 F.胶头滴管 G.50ml烧杯 H.100ml容量瓶 I.200ml容量瓶
实验室需用98ml 1.0mol/L 硫酸,现用浓硫酸(标签如下图)配制.实验仪器有:A.25ml量筒 B.托盘天平 C.玻璃棒 D.50ml容量瓶 E.10ml量筒 F.胶头滴管 G.50ml烧杯 H.100ml容量瓶 I.200ml容量瓶 汽车、电动车一般使用铅酸蓄电池.某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.请回答下列有关问题:
汽车、电动车一般使用铅酸蓄电池.某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.请回答下列有关问题: