题目内容
【题目】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3。工艺流程如下:
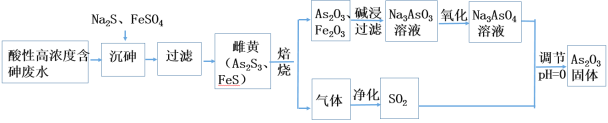
回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为________,“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是_________________________________。(写名称)
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为:_______________。
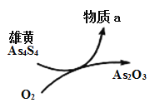
(5)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)
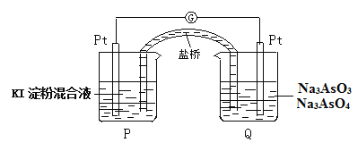
(6)某原电池装置如图,电池总反应为:AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
【答案】33 ![]() 与过量的S2-结合生成FeS沉淀,防止As2S3与S2-结合生成AsS33-(或与S2-结合生成FeS沉淀,使平衡左移,提高沉砷效果) 稀硫酸、铁氰化钾(或稀硫酸、高锰酸钾) 2AsO43-+2SO2+2H+=As2O3↓+ 2SO42-+H2O SO2 AsO43-+H2O+2e-
与过量的S2-结合生成FeS沉淀,防止As2S3与S2-结合生成AsS33-(或与S2-结合生成FeS沉淀,使平衡左移,提高沉砷效果) 稀硫酸、铁氰化钾(或稀硫酸、高锰酸钾) 2AsO43-+2SO2+2H+=As2O3↓+ 2SO42-+H2O SO2 AsO43-+H2O+2e-![]() AsO33-+2OH- 向Q加入Na3AsO3固体或加入碱(NaOH等)
AsO33-+2OH- 向Q加入Na3AsO3固体或加入碱(NaOH等)
【解析】
酸性高浓度含砷废水加入硫化钠、硫酸亚铁,其中硫酸亚铁可除去过量的硫离子,过滤得到As2S3和FeS,焙烧,可生成As2O3、氧化铁,加入氢氧化钠溶液生成Na3AsO3,氧化生成Na3AsO4,生成的气体为二氧化硫,与Na3AsO4在酸性条件下发生氧化还原反应生成As2O3,以此解答该题。
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,砷为第四周期元素,第二周期有8种元素,第三周期有18种元素,则两者原子序数相差8+18=26,故砷元素的原子序数为26+7=33,硫化钠为离子化合物,电子式为![]() ;
;
(2)亚铁离子与过量的S2-结合生成FeS沉淀,防止AS2O3与S2-结合生成AsS33-,即As2S3+3S2-![]() 2AsS32-使平衡逆向进行,提高沉砷效果;
2AsS32-使平衡逆向进行,提高沉砷效果;
(3)四氧化三铁含有+2价铁,具有还原性,可先用稀硫酸溶解,再在酸性条件下,滴加高锰酸钾溶液,溶液褪色,即可证明四氧化三铁存在,则可用硫酸、高锰酸钾检验;
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为2AsO43-+2SO2+2H+=As2O3↓+2SO42-+H2O;
(5)As4S4中As为+2价、S为-2价,且生成As2O3,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则4molS元素化合价升高6价,生成物化合价为+4价,应为SO2;
(6)P池中溶液由无色变成蓝色,说明P池Pt极为负极,则Q池中Pt极为正极,发生还原反应,电极反应为AsO43-+H2O+2e-=AsO33-+2OH-;一段时间后电流计指针不发生偏转,说明达到平衡状态,加入NaOH溶液,反应逆向进行,此时Q池中Pt极为负极,电子应由Q池流出,即指针偏转方向与起始时相反。

 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案