题目内容
2.质量数为27的元素R,其核内有14个中子,则R可形成的离子为( )| A. | R+ | B. | R2+ | C. | R3+ | D. | R2- |
分析 根据质量数=中子数+质子数可确定质子数,据此解题.
解答 解:质量数=中子数+质子数,元素R有13个质子.所以可以判断出最外层有3个电子,即有三个价电子,是Al元素,可形成的离子为R3+.
故选C.
点评 本题考查元素的判断,明确质量数与质子数、中子数之间的相互关系是解题的关键,题目难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案
相关题目
13.某物质在一定条件下按下式分解:2A═B↑+2C↑+2D↑,测得生成的混合气体在相同条件下密度是H2密度d倍,则A的式量为( )
| A. | 2d | B. | 2.5d | C. | 5d | D. | 10d |
17.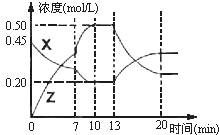 向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )
 向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)?bZ(g);△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.根据以上信息判断,下列说法中正确的是( )| A. | 化学方程式中a:b=1:3 | |
| B. | 推测在第7min时曲线变化的原因可能是升温 | |
| C. | 推测在第13min时该反应刚好达到化学平衡 | |
| D. | 用X表示O~10min内该反应的平均速率为v(X)=0.045mol•L-1•mol-1 |
14.1mol H2和32g O2的体积,前者与后者的关系是( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能确定 |
12.温度为T℃,压强为1.01×106Pa条件下,某密闭容器下列反应达到化学平衡A(g)+aB(?)?4C(g),达到化学平衡时测得c(A)=0.2mol•L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.36mol•L-1;若继续压缩容器,使压强增大到5.05×106Pa,第三次达到平衡时,测得c(A)=1.1mol•L-1;则下列关于有关说法不正确的是( )
| A. | 第二次平衡时B为气态 | |
| B. | a>3 | |
| C. | 第一次平衡后增大压强平衡向左移动 | |
| D. | 第三次达到平衡时B可能为非气态 |
 室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示.
室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1mol空气,此时活塞的位置如图所示.
 +2nH2O.
+2nH2O. +2NaOH$→_{△}^{H_{2}O}$CH2=CHCOONa+HO-CH2-CH2-CH2-OH+NaBr.
+2NaOH$→_{△}^{H_{2}O}$CH2=CHCOONa+HO-CH2-CH2-CH2-OH+NaBr.