题目内容
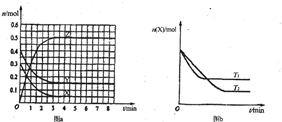
T0℃时,在2L的密闭容器中发生反应:aX(g)+bY(g)?cZ(g),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述不正确的是( )

| A.该反应的正反应是放热反应,且T1>T2 |
| B.X、Y、Z的化学反应速率之比为1:1:2 |
| C.图a中反应达到平衡时,Y的转化率为37.5% |
| D.若T1>T0,则该反应的化学平衡常数K(T1)<K(T0) |

A、由图b可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,故A正确;
B、由图a可知到达平衡时,X、Y、Z的物质的量变化量分别为0.25mol、0.25mol、0.5mol,速率之比等于物质的量变化量之比,所以X、Y、Z的化学反应速率之比为1:1:2,故B正确;
C、图a中反应达到平衡时,参加反应的Y的物质的量为0.25mol,开始时Y的物质的量为0.4mol,所以平衡时Y的转化率为
×100%=62.5%,故C错误;
D、由A分析可知,该正反应为放热反应,若T1>T0,升高温度平衡向吸热反应移动,即向逆反应移动,平衡常数减小,即
化学平衡常数K(T1)<K(T0),故D正确.
故选:D.
B、由图a可知到达平衡时,X、Y、Z的物质的量变化量分别为0.25mol、0.25mol、0.5mol,速率之比等于物质的量变化量之比,所以X、Y、Z的化学反应速率之比为1:1:2,故B正确;
C、图a中反应达到平衡时,参加反应的Y的物质的量为0.25mol,开始时Y的物质的量为0.4mol,所以平衡时Y的转化率为
| 0.25mol |
| 0.4mol |
D、由A分析可知,该正反应为放热反应,若T1>T0,升高温度平衡向吸热反应移动,即向逆反应移动,平衡常数减小,即
化学平衡常数K(T1)<K(T0),故D正确.
故选:D.

练习册系列答案
相关题目
 (2010?诸城市模拟)T0℃时,在2L的密闭容器中发生反应:aX(g)+bY(g)?cZ(g),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述不正确的是( )
(2010?诸城市模拟)T0℃时,在2L的密闭容器中发生反应:aX(g)+bY(g)?cZ(g),各物质的物质的量随时间变化的关系如图a所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示.下列叙述不正确的是( )
 T0℃时,在2L的密闭容器中,各物质(X(g)、Y(g)、Z(g))的物质的量随时间变化的关系如图1所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,Y的物质的量随时间变化的关系如图2所示.下列叙述正确的是( )
T0℃时,在2L的密闭容器中,各物质(X(g)、Y(g)、Z(g))的物质的量随时间变化的关系如图1所示.其他条件相同,温度分别为T1℃、T2℃时发生反应,Y的物质的量随时间变化的关系如图2所示.下列叙述正确的是( )