题目内容
下列各离子方程式都不正确,试指出错误的原因并写出正确的离子方程式。①向FeBr2溶液中滴入足量的氯水
2Fe2++2Br-+2Cl2====2Fe3++Br2+4Cl-
②向NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性
H++SO![]() +Ba2++OH-====BaSO4↓+H2O
+Ba2++OH-====BaSO4↓+H2O
③(NH4)2SO4溶液跟Ba(OH)2稀溶液混合
NH+4+OH-+SO![]() +Ba2+====NH3↑+H2O+BaSO4↓
+Ba2+====NH3↑+H2O+BaSO4↓
④碳酸氢钙溶液中加入大量氢氧化钠溶液
Ca2++HCO![]() +OH-====CaCO3↓+H2O
+OH-====CaCO3↓+H2O
解析:①由于FeBr2电离出的Fe2+、Br-均能被Cl2所氧化,当Cl2足量时,FeBr2完全作用,Fe2+与Br-个数之比必为1∶2。
正确的离子方程式为:2Fe2++4Br-+3Cl2====2Fe3++2Br2+6Cl-
②1 mol NaHSO4可电离出1 mol H+,而Ba(OH)2为二元强碱,可电离出2 mol OH-,故溶质的物质的量比为2∶1时,反应后溶液呈中性,即2NaHSO4+Ba(OH)2====BaSO4↓+Na2SO4+2H2O。但SO![]() 沉淀不完全。若溶质的物质的量之比为1∶1时,NaHSO4+Ba(OH)2====BaSO4↓+2NaOH+H2O,反应后SO
沉淀不完全。若溶质的物质的量之比为1∶1时,NaHSO4+Ba(OH)2====BaSO4↓+2NaOH+H2O,反应后SO![]() 沉淀完全,但溶液不呈中性,呈碱性。
沉淀完全,但溶液不呈中性,呈碱性。
正确的离子方程式为2H++SO![]() +Ba2++2OH-====BaSO4↓+2H2O
+Ba2++2OH-====BaSO4↓+2H2O
③铵盐在溶液中遇浓强碱或加热时才放NH3。该题忽略了反应客观事实,此外,该离子方程式化学计量数违反了物质组成。
正确的离子方程式:2NH![]() +SO
+SO![]() +Ba2++2OH-====2NH3·H2O+BaSO4↓
+Ba2++2OH-====2NH3·H2O+BaSO4↓
④弱酸的酸式盐和碱发生反应时要注意过量问题。哪一种物质完全反应,应按照化学式组成比写离子方程式,或者复杂的反应可先写化学方程式,再改写为离子方程式。
例如此题加入大量NaOH溶液,化学方程式为:Ca(HCO3)2+2NaOH====CaCO3↓+Na2CO3+2H2O
离子方程式为Ca2++2HCO![]() +2OH-====CaCO3↓+CO
+2OH-====CaCO3↓+CO![]() +2H2O。
+2H2O。
Ca(HCO3)2完全反应,在离子方程式中n(Ca2+)∶n(HCO![]() )=1∶2;若Ca(HCO3)2溶液中加入少量NaOH溶液,化学方程式为Ca(HCO3)2+NaOH====CaCO3↓+NaHCO3+H2O
)=1∶2;若Ca(HCO3)2溶液中加入少量NaOH溶液,化学方程式为Ca(HCO3)2+NaOH====CaCO3↓+NaHCO3+H2O
离子方程式:Ca2++HCO![]() +OH-====CaCO3↓+H2O,因为Ca(HCO3)2只部分反应,n(Ca2+)∶n(HCO
+OH-====CaCO3↓+H2O,因为Ca(HCO3)2只部分反应,n(Ca2+)∶n(HCO![]() )=1∶1即可。
)=1∶1即可。
答案:(错误的原因见解析)①2Fe2++4Br-+3Cl2====2Fe3++2Br2+6Cl-
②2H++SO![]() +Ba2++2OH-====BaSO4↓+2H2O
+Ba2++2OH-====BaSO4↓+2H2O
③2NH![]() +SO
+SO![]() +Ba2++2OH-====2NH3·H2O+BaSO4↓
+Ba2++2OH-====2NH3·H2O+BaSO4↓
④Ca2++2HCO![]() +2OH-====CaCO3↓+CO
+2OH-====CaCO3↓+CO![]() +2H2O
+2H2O

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如图所示转化关系(这些转化关系都不需要使用催化剂),回答下列问题:
A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如图所示转化关系(这些转化关系都不需要使用催化剂),回答下列问题:
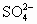 +Ba2++OH-=BaSO4↓+H2O
+Ba2++OH-=BaSO4↓+H2O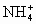 +OH-+
+OH-+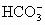 +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O