题目内容
12.高温煅烧碱式碳酸镁得到MgO.取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下CO2 0.896L,通过计算确定碱式碳酸镁的化学式.分析 生成固体2.00g为MgO,还生成水,结合n=$\frac{m}{M}$、n=$\frac{V}{Vm}$及原子守恒计算.
解答 解:n(CO2)=$\frac{0.896L}{22.4L/mol}$=4.00×10-2 mol,
n(MgO)=$\frac{2.00g}{40g/mol}$=5.00×10-2 mol,
n(H2O)=$\frac{4.66g-0.04mol×44g/mol-2.00g}{18g/mol}$=5.00×10-2 mol,
碱式碳酸镁分解生成n(MgO):n(CO2):n(H2O)=(5.00×10-2):(4.00×10-2):(5.00×10-2)=5:4:5,
可知碱式碳酸镁的化学式为Mg(OH)2•4MgCO3•4H2O,
答:碱式碳酸镁的化学式为Mg(OH)2•4MgCO3•4H2O.
点评 本题考查化学反应的计算,为高频考点,把握物质的量的计算、原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
相关题目
17.可检验FeC13溶液中是否含FeCl2的试剂是( )
| A. | KSCN溶液 | B. | 氯水 | C. | NaOH溶液 | D. | 酸性KMnO4溶液 |
18.下列说法正确的是( )
| A. | 蔬菜水果多属于碱性食物,对人体健康有益 | |
| B. | 棉花、合成橡胶都属于合成材料 | |
| C. | 蚕丝、羊毛完全燃烧只生成CO2和H2O | |
| D. | 苯、植物油均能使酸性KMnO4溶液褪色 |
15.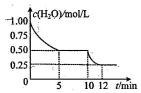 在2L密闭容器中进行反应C(s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确是( )
在2L密闭容器中进行反应C(s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确是( )
 在2L密闭容器中进行反应C(s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确是( )
在2L密闭容器中进行反应C(s)+H2O(g)?CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图.下列判断正确是( )| A. | 0~5min内,v(H2)=0.05mol/(L•min) | |
| B. | 5min时该反应的K值一定小于12min时的K值 | |
| C. | 10min时,改变的外界条件可能是减小压强 | |
| D. | 5min时该反应的v(正)大于11min时的v(逆) |
4.下列物质(括号内为少量杂质),能用饱和Na2CO3溶液并借助分液漏斗把杂质除去的是( )
| A. | 苯(硝基苯) | B. | 乙醇(乙酸) | C. | 乙酸乙酯(乙酸) | D. | 乙酸(苯) |
1.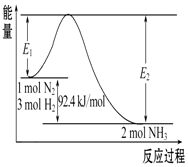 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.
合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.
(1)在反应体系中加入催化剂,反应速率增大,E2的变化是减小(填“增大”、“减小”或“不变”)
(2)该反应的反应热△H=-92.4KJ/mol,已知E2=212.4 kJ/mol,则该反应正反应的活化能是120KJ/mol
(3)该反应化学平衡常数的表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$该反应的化学平衡常数K和温度t的关系如表所示:
则K1>K2(填>、<、=)
(4)该反应的△S<0,(填大于、小于或等于),理论上在低温条件下可以自发.
 科学家一直致力于“人工固氮”的方法研究.
科学家一直致力于“人工固氮”的方法研究.合成氨的原理为:N2(g)+3H2(g)?2NH3(g),该反应的能量变化如图所示.
(1)在反应体系中加入催化剂,反应速率增大,E2的变化是减小(填“增大”、“减小”或“不变”)
(2)该反应的反应热△H=-92.4KJ/mol,已知E2=212.4 kJ/mol,则该反应正反应的活化能是120KJ/mol
(3)该反应化学平衡常数的表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$该反应的化学平衡常数K和温度t的关系如表所示:
| t℃ | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
(4)该反应的△S<0,(填大于、小于或等于),理论上在低温条件下可以自发.
 .
.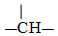 、
、 等结合而成的.试写出同时满足下列条件的烷烃的结构简式:
等结合而成的.试写出同时满足下列条件的烷烃的结构简式: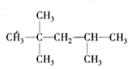
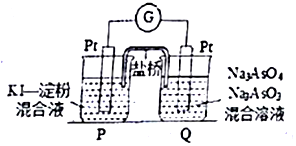 砷(As)是第四周期第VA族元素,用化学用语回答问题.
砷(As)是第四周期第VA族元素,用化学用语回答问题. ,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)
,其气态氢化物的稳定性比AsH3强(填“强”或“弱”)