题目内容
9.下列有关阿佛加德罗常数(NA)的说法错误的是( )| A. | 22.4LO2所含的分子数目为NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 7.8gmolNa2O2与H2O反应转移电子数目为0.1NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
分析 A、氧气所处的状态不明确;
B、水中含3个原子;
C、求出过氧化钠的物质的量,然后根据1mol过氧化钠反应时转移1mol电子来分析;
D、物质的量n=$\frac{N}{{N}_{A}}$.
解答 解:A、氧气所处的状态不明确,故无法根据气体求出其物质的量和分子个数,故A错误;
B、水中含3个原子,故0.5mol水中含1.5mol原子即1.5NA个,故B正确;
C、7.8g过氧化钠的物质的量为0.1mol,而1mol过氧化钠反应时转移1mol电子,故0.1mol过氧化钠转移0.1mol电子即0.1NA个,故C正确;
D、氯气的物质的量n=$\frac{N}{{N}_{A}}$=$\frac{0.5{N}_{A}}{{N}_{A}}$=0.5mol,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
20.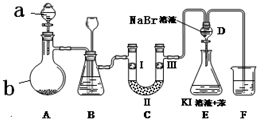 实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
(1)a、b两仪器的名称是:a分液漏斗;b圆底烧瓶.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体 主要成分为Ca(ClO)2和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c.
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明非金属性氯大于溴(填“大于”或“小于”).
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
 实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).(1)a、b两仪器的名称是:a分液漏斗;b圆底烧瓶.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体 主要成分为Ca(ClO)2和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
17.下列说法或做法正确的是( )
| A. | 用蒸发皿加热蒸发溶液时,盛液体的量不能超过其容积的$\frac{1}{3}$ | |
| B. | 用托盘天平可称10.50g K2SO4晶体 | |
| C. | 用10mL量筒量取8.50mL稀H2SO4溶液 | |
| D. | 加热坩埚不需要垫石棉网 |
4.1mol H2SO4中氧原子数( )
| A. | 1 mol | B. | 2 mol | C. | 3 mol | D. | 4 mol |
14.已知SO32-+I2+H2O=SO42-+2I-+2H+.某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色.则下列关于该溶液组成的判断正确的是( )
| A. | 肯定不含I- | B. | 肯定不含Cu2+ | C. | 可能含有SO32- | D. | 肯定不含有NH4+ |
1.在四种不同条件下测得反应2SO2+O2?2SO3的反应速如表所示:
其中反应速率最快的是( )
| 编号 | (1) | (2) | (3) | (4) |
| 反应速率[mol/(L.s)] | v(SO2) | v(O2) | v(SO3) | v(O2) |
| 0.4 | 0.25 | 0.5 | 0.3 |
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
18.下列说法中正确的是( )
| A. | 氨能在空气中燃烧,生成N2和水 | |
| B. | NO2溶于水生成HNO3,NO2属于酸性氧化物 | |
| C. | 所有的铵盐加热分解都能产生NH3 | |
| D. | 铜与浓硝酸反应时,硝酸既表现氧化性又表现酸性 |
19.某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1)①检查气体发生装置A的气密性的操作是关闭活塞a,打开止水夹b,将长导管末端浸入水中,用手捂住圆底烧瓶,导管口有气泡;松开手后,有水进入导管,则气密性良好;或方法二:关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好..
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化.
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2.
ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应.ⅲ.AgClO、AgBrO均可溶于水.
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-?Fe(SCN)3平衡逆向移动而褪色,请设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理.或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理.
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应产生Cl-,没有Br-生成,由于AgBrO易溶于水,加入AgNO3溶液,只能生成AgCl沉淀.
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为BrCl+2KI=KCl+KBr+I2.

(1)①检查气体发生装置A的气密性的操作是关闭活塞a,打开止水夹b,将长导管末端浸入水中,用手捂住圆底烧瓶,导管口有气泡;松开手后,有水进入导管,则气密性良好;或方法二:关闭止水夹b,打开活塞a,向分液漏斗中注水,若水不能顺利流下,则气密性良好..
②整套实验装置存在一处明显的不足,请指出缺少尾气处理装置.
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:Cl2>Br2>Fe3+ |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2.
ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应.ⅲ.AgClO、AgBrO均可溶于水.
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-?Fe(SCN)3平衡逆向移动而褪色,请设计简单实验证明上述解释:取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理.或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理.
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应产生Cl-,没有Br-生成,由于AgBrO易溶于水,加入AgNO3溶液,只能生成AgCl沉淀.
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为BrCl+2KI=KCl+KBr+I2.

 .
.