题目内容
1.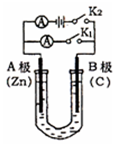 如图所示,U形管内盛有200mL的溶液,按要求回答下列问题.
如图所示,U形管内盛有200mL的溶液,按要求回答下列问题.(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为负 极,A极的电极反应式为Zn-2e-═Zn2+.若所盛溶液为KCl溶液:则B极的电极反应式为2O2+2H2O+4e-=4OH-,K+移向B 极(填A、B)
(2)打开K1,合并K2,若所盛溶液为2.5 mol•L-1CuSO4溶液,一段时间后有0.2mol电子发生转移
请回答下列问题:
阳极电极反应式为4OH--4e-=O2↑+2H2O,生成标准状况下气体,若用 等质量的两块铜片代替锌、石墨作电极,一段时间后有0.2mol电子发生转移,此刻两铜片的质量相差12.8g
(3)科研人员新近开发出一种由甲醇、氧气以及强碱作电解质溶液的新型手机电池,充电一次可供手机连续使用一个月,请回答以下问题:
甲醇是负 极,电极反应CH3OH+8OH--6e-═CO32-+6H2O.
分析 (1)若所盛溶液为CuSO4溶液,打开K2,合并K1,该装置是原电池,锌易失电子作负极、C电极为正极,C电极上铜离子得电子发生还原反应,电解质里的阳离子移向正极;
(2)打开K1,合并K2,得到的是电解池,阳极上发生氧化反应,根据电子守恒以及电极反应式进行计算即可;
(3)甲醇燃料电池放电时,C元素的化合价升高,所以甲醇所在电极为原电池的负极,O元素的化合价降低,所以通入氧气的极为原电池的正极,负极上发生氧化反应,正极上发生还原反应,以此来解答.
解答 解:(1)若所盛溶液为CuSO4溶液,打开K2,合并K1,该装置是原电池,锌易失电子作负极、C电极为正极,C电极上铜离子得电子发生还原反应,电极反应为Cu2++2e-=Cu,若所盛溶液为KCl溶液,则B极是正极,发生得电子的还原反应,电极反应式为:2O2+2H2O+4e-=4OH-,钾离子移向正极,移向B极,
故答案为:负;Zn-2e-═Zn2+;2O2+2H2O+4e-=4OH-;B;
(2)打开K1,合并K2,得到的是电解池,阳极上发生氧化反应:4OH--4e-=O2↑+2H2O,A电极上铜离子得电子发生还原反应,电极反应为Cu2++2e-=Cu,若用等质量的两块铜片代替锌、石墨作电极,则阳极上:Cu-2e-═Cu2+,阴极上发生反应Cu2++2e-=Cu,一段时间后有0.2mol电子发生转移,此刻两铜片的质量相差0.1mol×64g/mol×2=12.8g,故答案为:4OH--4e-=O2↑+2H2O;12.8g;
(3)CH3OH和O2在电池中,肯定是O2氧化CH3OH,CH3OH是负极反应物,O2是正极反应物.CH3OH被氧化生成CO2和H2O,电解质溶液中有强碱(OH-),CO2要转化CO32-,甲醇是负极,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,故答案为:负;CH3OH+8OH--6e-═CO32-+6H2O.
点评 本题考查了原电池和电解池工作原理的应用知识,题目难度中等,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

| A. | CH3COO-+H2O?CH3COOH+OH- | B. | NH4++H2O?NH4OH+H+ | ||
| C. | HCO3-+H2O?CO2↑+H2O | D. | NaCl+H2O?NaOH+HCl |
| A. |  | B. |  | C. |  | D. |  |
 如图表示反应N2 (g)+3H2(g)?2NH3(g)△H<0的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )
如图表示反应N2 (g)+3H2(g)?2NH3(g)△H<0的正反应速率随时间的变化情况,试根据如图曲线判断下列说法可能正确的是( )| A. | tl时减小了压强 | |
| B. | t1时降低了温度 | |
| C. | tl时减小N2滚度,同时增加了NH3的浓度 | |
| D. | t1时减小了NH3的浓度,平衡向正反应方向移动 |
| A. | 溴水和碘水 | B. | 盐酸和稀硫酸 | C. | 溴水和稀盐酸 | D. | 氯化钾和碘水 |
| A. | HCl | B. | NaClO | C. | MgCl2 | D. | NaCl |
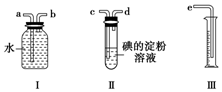 已知SO2+I2+2H2O═H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中的SO2的含量.
已知SO2+I2+2H2O═H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中的SO2的含量.