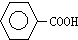题目内容
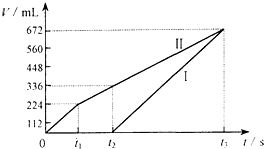 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(1)原混合溶液中CuSO4的物质的量浓度为
(2)t2时所得溶液的c(H+)为
(3)电解至t3时,消耗水的质量
考点:电解原理
专题:电化学专题
分析:电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,以此来计算.
解答:
解:电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,
(1)由图可知,产生氯气为224mL即
=0.01mol,则由2Cl--2e-=Cl2↑可知,由t2时生成氧气为112mL,n(O2)=
=0.005mol,则共转移电子为0.01mol×2+0.005mol×4=0.04mol,
根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=
=0.02mol,所以c(CuSO4)=
=0.1mol/L,
故答案为:0.1mol/L;
(2)由t2时4OH--4e-=O2↑+2H2O~4H+,n(H+)=0.005mol×4=0.02mol,则溶液的c(H+)=
=0.1mol/L,
故答案为:0.1mol/L;
(3)电解至t3时,电解生成氧气为672-224mL=448mL,均来源于水,由2H2O
O2↑+2H2↑,n(H2O)=
×2=0.04mol,所以电解水的质量为0.04mol×18g/mol=0.72g,故答案为:0.72g.
(1)由图可知,产生氯气为224mL即
| 0.224L |
| 22.4L/mol |
| 0.112L |
| 22.4L/mol |
根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=
| 0.04mol |
| 2 |
| 0.02mol |
| 0.2L |
故答案为:0.1mol/L;
(2)由t2时4OH--4e-=O2↑+2H2O~4H+,n(H+)=0.005mol×4=0.02mol,则溶液的c(H+)=
| 0.02mol |
| 0.2L |
故答案为:0.1mol/L;
(3)电解至t3时,电解生成氧气为672-224mL=448mL,均来源于水,由2H2O
| ||
| 0.448L |
| 22.4L/mol |
点评:本题考查电解原理,明确发生的电极反应及图图象的对应关系是解答本题的关键,注意(3)中计算电解水的质量可利用生成氧气的体积直接计算,题目难度中等.

练习册系列答案
相关题目
下述四个反应中,酸所体现的性质与其他三者明显不同的是( )
| A、浓盐酸与二氧化锰共热制氯气 |
| B、浓硫酸与铜片加热 |
| C、浓硝酸与铜反应 |
| D、稀硝酸与铜反应 |
在铁制品上面镀上一定厚度的锌层,以下设计方案正确的是( )
| A、铁作阳极,镀件作阴极,溶液中含有亚铁离子 |
| B、铂作阴极,镀件作阳极,溶液中含有锌离子 |
| C、锌作阳极,镀件作阴极,溶液中含有锌离子 |
| D、锌用阴极,镀件作阳极,溶液中含有锌离子 |
你认为下列行为中与“节能减排,和谐发展”不相符的是( )
| A、开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 |
| B、将煤进行气化处理,提高煤的综合利用效率 |
| C、大量开采煤、石油,提高产量以满足工业生产的快速发展 |
| D、实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
氯在自然界以化合物形态存在,18世纪70年代,首先发现并制得氯气的化学家是( )
| A、汤姆生 | B、舍勒 |
| C、阿伏加德罗 | D、戴维 |
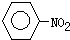
 (苯胺,弱碱性、易氧化)
(苯胺,弱碱性、易氧化)