题目内容
11.下列叙述中不正确的是( )| A. | 常用铝盐溶液与氨水反应制取氢氧化铝 | |
| B. | 澄清石灰水盛装在用玻璃塞塞紧的试剂瓶中 | |
| C. | 氢气在氯气中燃烧产生苍白色火焰 | |
| D. | 新制氯水通常保存在棕色试剂瓶 |
分析 A.氢氧化铝不溶于弱碱;
B.玻璃的主要成分是二氧化硅,可以和强碱反应;
C.氢气在氯气中燃烧产生苍白色火焰;
D.氯水中的次氯酸见光易分解,导致氯水失效.
解答 解:A.实验室可用氨水与铝盐反应制取氢氧化铝,氢氧化铝不溶于弱碱,故A正确;
B.玻璃的主要成分是二氧化硅,可以和强碱反应,澄清石灰水盛装在用橡胶塞塞紧的试剂瓶中,故B错误;
C.氢气在氯气中燃烧产生苍白色火焰,瓶口有白雾,故C正确;
D.氯水中的次氯酸见光易分解,新制氯水通常保存在棕色试剂瓶中,故D正确.
故选B.
点评 本题考查物质的制备、试剂的保存知识,可以根据物质的性质来回答,注意知识的积累是解题的关键,难度不大.

练习册系列答案
相关题目
1.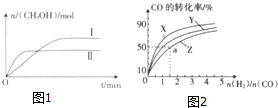 在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
(1)曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”、“<”或“=”).
(2)一定温度下,在容积均为1L,且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,则:
①平衡后乙中的压强(p乙)和甲中的压强(p甲)关系为c
a.P乙=2p甲 b.P乙>2P甲 c.P乙<2p甲 d无法确定
②平衡后乙中CH3OH(g)的浓度为b
a.等于0.8mol•L-1 b.大于0.8mol•L-1 c.小于0.8mol•L-1 d.无法确定
(3)一定温度下,此反应若在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd;
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)若将反应物CO2改为CO,也能合成甲醇:CO(g)+2H2(g)?CH3(OH)(g)△H=-90.8kJ•mol-1
如图2是在容积为1L的恒容容器中,在230℃、250℃和270℃三种温度下,H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO的平衡转化率的关系图.反应CO(g)+2H2(g)?CH3OH(g)的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$;曲线Z对应的温度是270℃;若增大H2的用量,该反应的热效应最大值为略小于90.8kJ.
 在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.
在一定体积的密闭容器中,通入一定量的CO2和H2,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图1.(1)曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”、“<”或“=”).
(2)一定温度下,在容积均为1L,且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2,3mol H2 | 2mol CO2,6mol H2 |
①平衡后乙中的压强(p乙)和甲中的压强(p甲)关系为c
a.P乙=2p甲 b.P乙>2P甲 c.P乙<2p甲 d无法确定
②平衡后乙中CH3OH(g)的浓度为b
a.等于0.8mol•L-1 b.大于0.8mol•L-1 c.小于0.8mol•L-1 d.无法确定
(3)一定温度下,此反应若在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd;
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)若将反应物CO2改为CO,也能合成甲醇:CO(g)+2H2(g)?CH3(OH)(g)△H=-90.8kJ•mol-1
如图2是在容积为1L的恒容容器中,在230℃、250℃和270℃三种温度下,H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO的平衡转化率的关系图.反应CO(g)+2H2(g)?CH3OH(g)的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$;曲线Z对应的温度是270℃;若增大H2的用量,该反应的热效应最大值为略小于90.8kJ.
2.铝用来焊接钢轨是利用( )
| A. | 铝同氧气反应生成稳定的保护层 | B. | 铝是热的良导体 | ||
| C. | 铝是强还原剂,铝热反应放热 | D. | 铝合金强度大 |
19.下列过程中需要吸收热量的是( )
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | H2→2H | ||
| C. | CaO+H2O=Ca(OH)2 | D. | 2Cl→Cl2 |
6.下列反应的离子方程式书写正确的是( )
| A. | 碳酸钙和醋酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氢氧化镁与硫酸溶液反应 H++OH-=H2O | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O=Al (OH)3↓+3NH4+ | |
| D. | 钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ |
16.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
| A. | 正丁烷 | B. | 异丁烷 | C. | 甲烷 | D. | 丙烷 |
3.根据下列有关图象判断,下列说法正确的是( )


| A. | 由图象Ⅰ可知,该反应在T1、T3处达到平衡 | |
| B. | 由图象Ⅰ可知,该反应的△H>0 | |
| C. | 图象Ⅱ发生反应的化学方程式为2X+6Y?3Z | |
| D. | 由图象Ⅱ可知,相同条件下起始时投入0.1mol•L-1 Y、0.3mol•L-1 Z和0.4mol•L-1 Z反应,达到平衡后,Z的浓度为0.4mol•L-1 |
20.X元素的一个原子失去两个电子转移到Y元素的两个原子中去,形成离子化合物Z,下列说法中错误的是( )
| A. | Z可以电离 | B. | Z可以表示为:XY2 | C. | X形成+2价阳离子 | D. | Z的电子式为 |
1.下列化学用语不能正确解释相关事实的是( )
| A. | 碱性氢氧燃料电池的正极反应:H2-2e-+2OH-═2H2O | |
| B. | 用电子式表示NaCl的形成过程: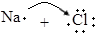 →Na+[ →Na+[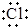 ]- ]- | |
| C. | 少量二氧化硫通入次氯酸钠碱性溶液中:SO2+C1O一+2OH-═SO42-+Cl-+H2O | |
| D. | 汽车尾气系统的催化转化器可降低NO等的排放:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2 |