题目内容
2.下列说法正确的是( )| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)→C(石墨)△H=-1.9KJ/mol 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=+285.8KJ/mol | |
| D. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-53.7KJ/mol,若将含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量小于53.7KJ |
分析 A.反应物中气态比固态能量高,生成物相同;
B.能量越低,物质越稳定;
C.2gH2完全燃烧生成液态水,放出285.8KJ热量,焓变为负;
D.醋酸电离吸热.
解答 解:A.反应物中气态比固态能量高,生成物相同,则等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多,故A错误;
B.能量越低,物质越稳定,则石墨能量低,石墨稳定,故B错误;
C.2gH2完全燃烧生成液态水,放出285.8KJ热量,焓变为负,则热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol,故C错误;
D.醋酸电离吸热,则含1 mol CH3COOH与含1 mol NaOH的溶液混合,放出的热量小于53.7KJ,故D正确;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、能量与稳定性为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
12.甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙十丁→沉淀;乙+丁→无色无味气体.则甲、乙、丙、丁四种溶液依次是( )
| A. | BaCl2、Na2CO3、盐酸、AgNO3 | B. | Na2CO3、盐酸、AgNO3、BaCl2 | ||
| C. | BaCl2、Na2CO3、AgNO3、盐酸 | D. | AgNO3、盐酸、BaCl2、Na2CO3 |
13.在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时c(CO2) 随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )

| A. | 该反应的△H>0、△S<0 | B. | 体系的总压强p:p (Ⅰ)>p (Ⅲ) | ||
| C. | 平衡常数:K(Ⅰ)>K (Ⅱ) | D. | T1K时,Ⅳ点所处的状态中 v(正)<v(逆) |
17.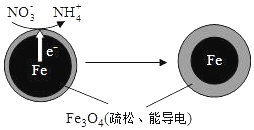 用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.
(1)Fe 还原水体中NO3- 的反应原理如图所示.
①作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经 24 小时测 定NO3- 的去除率和 pH,结果如下:
pH 由 2.5 变为 4.5 时,NO3- 的去除率低,是因为生成了较多的不导电的FeO(OH),写出生成FeO(OH)的离子方程式:Fe3++2H2O?FeO(OH)+3H+.
(3)实验发现:在初始 pH=4.5 的水体中投入足量铁粉的同时,补充一定量的 Fe2+可以明显提高NO3- 的去除率.是因为 Fe2+能够破坏FeO(OH),氧化层生成Fe2O3.写出该反应的离子方式Fe2++2FeO(OH)=Fe3O4+2H+.
 用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.
用零价铁(Fe)去除水体中的硝酸盐(NO3- )已成为环境修复研究的热点之一.(1)Fe 还原水体中NO3- 的反应原理如图所示.
①作负极的物质是铁.
②正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
(2)将足量铁粉投入水体中,经 24 小时测 定NO3- 的去除率和 pH,结果如下:
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 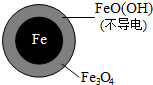 |  |
(3)实验发现:在初始 pH=4.5 的水体中投入足量铁粉的同时,补充一定量的 Fe2+可以明显提高NO3- 的去除率.是因为 Fe2+能够破坏FeO(OH),氧化层生成Fe2O3.写出该反应的离子方式Fe2++2FeO(OH)=Fe3O4+2H+.
7.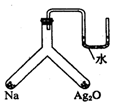 充分加热如图所示的密闭容器中放置有试剂的两个位置,若钠与氧化银均友应完且恢复到原来的温度时,U形管左右两侧液面相平,下列有关说法错误的是( )
充分加热如图所示的密闭容器中放置有试剂的两个位置,若钠与氧化银均友应完且恢复到原来的温度时,U形管左右两侧液面相平,下列有关说法错误的是( )
 充分加热如图所示的密闭容器中放置有试剂的两个位置,若钠与氧化银均友应完且恢复到原来的温度时,U形管左右两侧液面相平,下列有关说法错误的是( )
充分加热如图所示的密闭容器中放置有试剂的两个位置,若钠与氧化银均友应完且恢复到原来的温度时,U形管左右两侧液面相平,下列有关说法错误的是( )| A. | 装置内空气成分保持不变 | B. | 热稳定性:钠的氧化物强于Ag2O | ||
| C. | 装置内钠与Ag2O物质的量比为2:1 | D. | 有淡黄色固体生成 |
14.下列化学用语表述一定正确的是( )
| A. | 甲醛的电子式: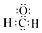 | |
| B. | 苯酚钠溶液中中通入少量二氧化碳气体: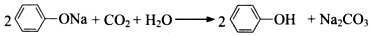 | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| D. | 乙醇与灼热的氧化铜反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O |
11.将28g铁粉和8g硫粉混合隔绝空气加热,在反应后的物质中加足量盐酸,可生成标况下气体体积为( )
| A. | 11.2L | B. | 5.6L | C. | 8.4L | D. | 14L |
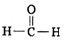 )中含有的共用电子对总数为2NA
)中含有的共用电子对总数为2NA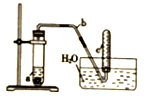 用图示简易装置可以进行某些氮氧化物气体的制取、收集及性质检验.
用图示简易装置可以进行某些氮氧化物气体的制取、收集及性质检验.