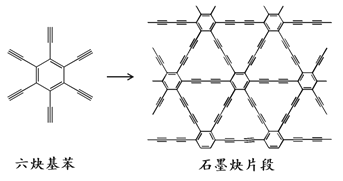
��Ŀ����
����Ŀ��2019��7��1�����Ϻ�������������ǿ��ʱ������������ȵ�Ҳ��ʼʵ���������ࡣ���������ҹ����������ľ��ģ������������뻯ѧϢϢ��أ������й�˵���������(![]() )
)
A.�ɻ��յ��������к�����������ͨ�����������������ȡ
B.���ޡ��顢˿��ë���ϳ���ά�ķϾ�����ȼ�մ���ʱ��ֻ����CO2��H2O
C.�����ľ���ϩ�������ڰ�ɫ����������ʹ��ˮ��ɫ
D.�Ͼɵ���к��������ӵ��ؽ�����������������
���𰸡�B
��������
A���ɻ��յ��������к�����������ҵ�õ�������������ķ�����ȡ������A��ȷ��
B��˿��ë��Ҫ�ɷ�Ϊ�����ʣ�����NԪ�أ����ղ�����˶�����̼��ˮ��е����������B����
C������ϩ�ѽ��⣬����̼̼˫������������ˮ��Ӧ����C��ȷ��
D���Ͼɵ���к��������ӵ��ؽ��������������������Ⱦ��Ӧ���մ�������D��ȷ��
��ѡ��B��

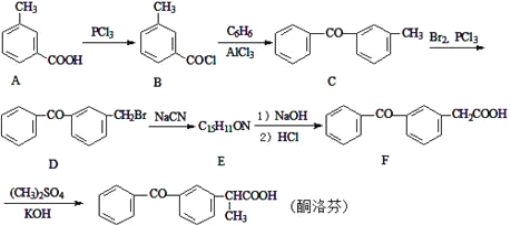
 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�����о�NxOy��CO��SO2�ȴ�����Ⱦ���ˮ��Ⱦ��Ĵ����Խ��������й�������Ҫ���塣
(1)��֪����NO2+CO![]() CO2+NO�÷�Ӧ��ƽ�ⳣ��ΪK1(��ͬ)��ÿ1mol�������ʷֽ�Ϊ��̬��̬ԭ�����յ������ֱ�Ϊ
CO2+NO�÷�Ӧ��ƽ�ⳣ��ΪK1(��ͬ)��ÿ1mol�������ʷֽ�Ϊ��̬��̬ԭ�����յ������ֱ�Ϊ
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
��N2(g)+O2(g)![]() 2NO(g) ��H=+179.5kJ/mol K2
2NO(g) ��H=+179.5kJ/mol K2
��2NO(g)+O2(g)![]() 2NO2(g) ��H=��112.3kJ/mol K3
2NO2(g) ��H=��112.3kJ/mol K3
д��NO��CO��Ӧ��������Ⱦ������Ȼ�ѧ����ʽ_____________________�����Ȼ�ѧ����ʽ��ƽ�ⳣ��K=______________________(��K1��K2��K3��ʾ)
(2)ֱ���ŷź�SO2���������γ����꣬Σ������������NaOH���գ����ú������(H2SO3��HSO3-��SO32-)�����ڷ�Ӧ�����Һ�У����ǵ����ʵ�������X����ҺpH�Ĺ�ϵ��ͼ��ʾ��
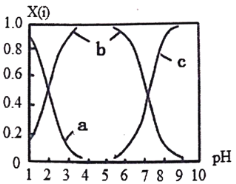
�ٲ����Һ��pH=8ʱ����Һ�и�����Ũ���ɴ�С��˳����___________��
���� NaHSO3��Һ�еμ�һ��Ũ�ȵ�CaCl2��Һ����Һ�г��ֻ��ǣ�pH���ͣ��û�ѧƽ���ƶ�ԭ��������ҺpH���͵�ԭ��________________________��
(3)��һ���¶��µĺ��������У���Ӧ2N2O(g)![]() 2N2(g)+O2(g)�IJ���ʵ���������£�
2N2(g)+O2(g)�IJ���ʵ���������£�
��Ӧʱ ��/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
����0~40minʱ�Σ���Ӧ����v(N2O)Ϊ___________mol/(L��min)��
����N2O��ʼŨ��c0Ϊ0.150 mol/L����Ӧ��30mnʱN2O��ת����a=___________��
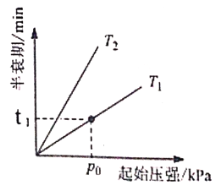
�۲�ͬ�¶�(T)�£�N2O�ֽ��˥������ʼѹǿ�ı仯��ϵ��ͼ��ʾ(ͼ�а�˥��ָ��һŨ��N2O����һ��ʱ�������Ӧʱ��)����T1___________T2(�>������=����<��)�����¶�ΪT1����ʼѹǿΪp0����Ӧ��t1minʱ����ϵѹǿp=___________(��p0��ʾ)
����Ŀ��������25��ʱ�������ܵ���ʵ��ܽ�ȣ�
���ܵ���� | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
�ܽ��/g | 9��10��4 | 1.7��10��6 | 1.5��10��4 | 3.0��10��9 |
������������ᴿ�У����������ܵ���ʵ��ܽ�ƽ��ԭ����ȥijЩ���ӣ��磺
��Ϊ�˳�ȥ�Ȼ���е�����Fe3�����Ƚ����������ˮ���ټ���һ�������Լ���Ӧ�����˽ᾧ���ɣ�
��Ϊ�˳�ȥ�Ȼ�þ�����е�����Fe3�����Ƚ����������ˮ������������������þ����ַ�Ӧ�����˽ᾧ���ɣ�
��Ϊ�˳�ȥ����ͭ�����е�����Fe2�����Ƚ����������ˮ������һ������H2O2����Fe2��������Fe3����������Һ��pH��4�����˽ᾧ���ɣ�
��ش��������⣺
��1�������������ӷ������ܹ��ﵽ�ܺõ�Ч����Fe2����Fe3������ת��Ϊ____________(�ѧʽ)����ȥ��
��2�����м�����Լ�Ӧ��ѡ��________Ϊ�ˣ���ԭ����__________��
��3�����г�ȥFe3�����������ܷ�Ӧ�����ӷ���ʽΪ______________________________��
��4�������뷽������ص������У���ȷ����______(����ĸ)��
A��H2O2����ɫ�������������������в��������ʣ���������Ⱦ
B����Fe2������ΪFe3������Ҫԭ����Fe(OH)2������Fe(OH)3�������ѹ���
C��������ҺpH��4��ѡ����Լ���������ͭ���ʽ̼��ͭ������ͭ
D��Cu2�����Դ���������pH��4����Һ��
E����pH��4����Һ��Fe3��һ�����ܴ�������