题目内容
15.下列各组离子在指定溶液中能大量共存的是( )| A. | 酸性溶液中:Na+、Cl-、OH-、CO32- | B. | 碱性溶液中:Fe3+、NH4+、HCO3-、Cl- | ||
| C. | 无色溶液中:Na+、Cu2+、MnO4-、I- | D. | 透明溶液中:Na+、Fe3+、Cl-、SO42- |
分析 A.酸性溶液含大量的氢离子;
B.碱性溶液中含大量的氢氧根离子;
C.Cu2+为蓝色、MnO4-为紫色;
D.该组离子之间不反应.
解答 解:A.酸性溶液含大量的氢离子,不能大量存在OH-、CO32-,故A错误;
B.碱性溶液中含大量的氢氧根离子,不能大量存在Fe3+、NH4+、HCO3-,故B错误;
C.Cu2+为蓝色、MnO4-为紫色,与无色不符,故C错误;
D.该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
相关题目
5.下列与金属腐蚀有关的说法,正确的是( )


| A. | 图1中,铁钉易被腐蚀 | |
| B. | 图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | |
| C. | 图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
6.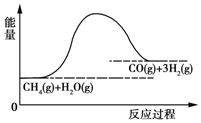 合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )
合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )
 合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )
合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )| A. | △H<0,△S<0 | B. | △H>0,△S<0 | C. | △H<0,△S>0 | D. | △H>0,△S>0 |
3.氯化铁可用作金属蚀刻、有机合成的催化剂,研究其制备及性质是一个重要的课题.
(1)氯化铁晶体的制备如图1:

①实验过程中装置乙发生反应的离子方程式有Fe+2H+=Fe2++H2↑、C12+2Fe2+=2Fe3++2Cl-,仪器丙的作用为吸收多余的氯气.
②为顺利达成实验目的,上述装置中弹簧夹打开和关闭的顺序为关闭弹簧夹1和3,打开弹簧夹2,待铁粉完全溶解后打开弹簧夹1和3,关闭弹簧夹2.
③反应结束后,将乙中溶液边加入浓盐酸,边进行加热浓缩、冷却结晶、过滤、洗涤、干燥即得到产品.
(2)氯化铁的性质探究:
某兴趣小组将饱和FeC13溶液进行加热蒸发、蒸干灼烧,在试管底部得到固体.为进一步探究该固体的成分设计了如下实验.(查阅文献知:
①FeC13溶液浓度越大,水解程度越小
②氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2
③FeC12熔点670℃)
(1)氯化铁晶体的制备如图1:

①实验过程中装置乙发生反应的离子方程式有Fe+2H+=Fe2++H2↑、C12+2Fe2+=2Fe3++2Cl-,仪器丙的作用为吸收多余的氯气.
②为顺利达成实验目的,上述装置中弹簧夹打开和关闭的顺序为关闭弹簧夹1和3,打开弹簧夹2,待铁粉完全溶解后打开弹簧夹1和3,关闭弹簧夹2.
③反应结束后,将乙中溶液边加入浓盐酸,边进行加热浓缩、冷却结晶、过滤、洗涤、干燥即得到产品.
(2)氯化铁的性质探究:
某兴趣小组将饱和FeC13溶液进行加热蒸发、蒸干灼烧,在试管底部得到固体.为进一步探究该固体的成分设计了如下实验.(查阅文献知:
①FeC13溶液浓度越大,水解程度越小
②氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2
③FeC12熔点670℃)
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因排出装置内的空气 |
| 关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因FeC13易升华 |
| 实验结束,振荡C静置 | ③溶液分层,上层接近无色,下层橙红色 | ④2FeC13$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl2+Cl2,2Br-+Cl2=Br2+2Cl-(用相关的方程式说明) |
| ⑤结合以上实验和文献资料,该固体可以确定的成分有FeC13、Fe2O3. | ||
10.a、b、c、d为原子序数依次增大的四种短周期主族元素.a的最外层电子数是内层电子数的3倍,b的M层上有1个电子,a与c同主族.下列说法不正确的是( )
| A. | 原子半径:b>c>d | |
| B. | 气态氢化物稳定性:a>c | |
| C. | 简单阴离子还原性:d>c | |
| D. | ab可形成既含离子键又含共价键的离子化合物 |
20.下列有关胶体及分散系的说法正确的是( )
| A. | 胶体粒子直径大于100nm | |
| B. | 丁达尔效应可以用于检验胶体 | |
| C. | 将FeCl3溶液滴加到氢氧化钠溶液中即可制得氢氧化铁胶体 | |
| D. | 分离胶体和溶液可以采用过滤的方法 |
5.某同学将光亮镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生.为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是( )
| 选项 | 实验及现象 | 结论 |
| A | 将湿润红色石蕊试纸靠近试管口 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.0 | 生成Mg(OH)2使溶液呈弱碱性 |
| D | 向NH4Cl溶液中加锌,也有大量气泡产生 | 活泼金属可促进NH4+水解 |
| A. | A | B. | B | C. | C | D. | D |