题目内容
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 1L0.1mol•L-1的氨水中含有的NH3分子数为0.1NA | |
| B. | 标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA | |
| C. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA | |
| D. | 标准状况下,Na2O2与足量CO2反应生成2.24L O2,转移电子数为0.4NA |
分析 A.NH3与水结合生成一水合氨;
B.标准状况下,四氯化碳是液体;
C.依据葡萄糖和冰醋酸的最简式相同,计算分析判断;
D.2.24L O2的物质的量为0.1mol.
解答 解:A.NH3与水结合生成一水合氨,一水合氨能发生电离,故A错误;
B.标准状况下,2.24L的CCl4的物质的量不是0.1mol,故B错误;
C.葡萄糖和冰醋酸最简式相同,3.0g由葡萄糖和冰醋酸最简式CH2O的物质的量为0.1mol,含有原子数为0.4NA,故C正确;
D.2.24L O2的物质的量为0.1mol,转移电子数为0.2NA,故D错误.
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | HClO2→ClO2+Cl2+H2O(未配平),1 mol HClO2分解时转移电子的物质的量为1 mol | |
| B. | 标准状况下,28 g CO、C2H4混合气体与22.4 L N2所含有的分子数都是NA | |
| C. | 与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+ | |
| D. | 在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO3+2CO2 |
16.在0.5L的密闭容器中,一定量的H2和N2进行如下化学反应:3H2(g)+N2(g)═2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表.请回答下列问题.
①比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃时,当测得NH3和N2、H2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(H2)正> V (H2)逆(填写“>”、“=”或“<”).
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②在400℃时,当测得NH3和N2、H2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(H2)正> V (H2)逆(填写“>”、“=”或“<”).
15.下列实验方法能达到实验目的是( )
| A. | 用分液漏斗分离水与乙醇的混合物 | |
| B. | 用激光笔检验淀粉溶液的丁达尔现象 | |
| C. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 |
 固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法: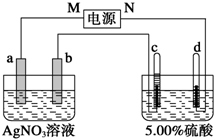 图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答:
图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.通电一段时间后,在c、d两极上共收集到336mL (标准状况)气体.回答: