题目内容
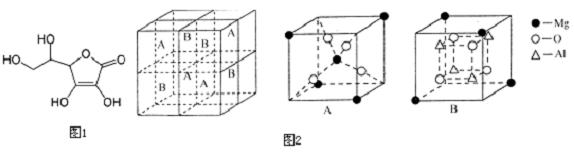
7.化学中的某些元素是与生命活动密不可分的元素,请回答下列问题.(1)维生素C是一种水溶性维生素,水果和蔬菜中含量丰富,该物质结构简式如图1所示.
①维生素C分子中碳原子的杂化方式有sp3和sp2.
②1mol维生素C分子中含有2mol π键.
③维生素C分子中所含元素电负性由大到小的顺序为O>C>H.
④维生素C晶体溶于水的过程中要克服的微粒间作用力有氢键、范德华力.
(2)KSCN溶液可用于Fe3+的检验,原因是铁离子外围有较多能量相近的空轨道,因此能与一些分子或离子形成配合物.Fe3+的价电子排布为3d5,与之形成配合物的分子或离子中的配位原子应具备的结构特征是有孤电子对.
(3)Fe3O4具有反尖晶石结构.某化合物MgxAlyOz与反尖晶石结构相仿,其结构如2图所示,它是由下列A、B方块组成.该化合物的化学式为MgAl2O4.
分析 (1)①根据价层电子对互斥理论确定C原子杂化方式;
②双键中含有1个π键;
③非金属性越强,电负性越强.
④分子间存在范德华力,羟基间能形成氢键;
(2)根据元素符号,判断元素原子的核外电子数,再根据构造原理来写;形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对;
(3)利用均摊法计算该晶胞中含有的原子个数,从而确定其化学式.
解答 解:(1)①维生素C分子中碳原子以单键形式存在的,其价层电子对个数是4,含有双键的C原子的价层电子对个数是3,所以C原子杂化方式为sp3杂化、sp2杂化,
故答案为:sp3和sp2;
②双键中含有1个π键,则1mol分子中含有2mol双键,即含有2mol π键,故答案为:2mol;
③.非金属性越强,电负性越强,非金属性:O>C>H,则电负性:O>C>H,故答案为:O>C>H;
④维生素C分子间存在范德华力,分子中含有羟基,羟基间能形成氢键,所以维生素C晶体溶于水的过程中要克服的微粒间作用力有氢键、范德华力,
故答案为:氢键、范德华力;
(2)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,Fe失去三个电子得到Fe3+,Fe3+的电子排布式为1s22s22p63s23p63d5;所以基态Fe3+的价电子排布式为3d5;形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对,则与Fe3+形成配合物的分子或离子中的配位原子应具备的结构特征是有孤电子对;
故答案为:3d5;有孤电子对;
(3)该晶胞中Al原子个数为4,O原子个数4+4=8,Mg原子的个数为8×$\frac{1}{8}$+1=2,所以化学式为MgAl2O4,
故答案为:MgAl2O4.
点评 本题考查了物质结构和性质,题目比较综合,侧重对物质结构主干知识的考查,涉及电负性、杂化理论、化学键、分子结构与性质、晶体类型与性质、晶胞计算等,需要学生能熟练把握基础知识,难度中等.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案| A. | 生成SO3 2mol | |
| B. | SO2和SO3物质的量之和一定为2mol | |
| C. | 反应放出197kJ的热量 | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
| A. | 直线 sp杂化 | B. | V型 sp2杂化 | ||
| C. | 三角锥形 sp3杂化 | D. | 平面三角形 sp2 杂化 |
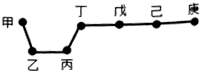 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素.下列判断正确的是( )| A. | 甲一定是金属元素 | |
| B. | 气态氢化物的稳定性:庚>己>戊 | |
| C. | 庚的最高价氧化物的水化物酸性最强 | |
| D. | 乙、丙、丁的最高价氧化物的水化物可以以相互反应 |
| A. | 离子半径:K+>Mg2+>Na+ | |
| B. | 热稳定性:NaHCO3>Na2CO3>H2CO3 | |
| C. | 结合H+的能力:OH->ClO->HCO3- | |
| D. | 相同pH的HCl和CH3COOH加水稀释相同倍数,pH:CH3COOH>HCl |
(1)C位于元素周期表第二周期第IVA族;Cr的基态原子核外电子排布式为1s22s22p63s23p63d54s1;C2H2分子中σ键与π键数目之比为3:2.
(2)用“>”或“<”填空:
| 电负性 | 键长 | 键的极性 | 沸点(同压) |
| C<N | C=C<C-C | N-H<O-H | 甲醇>丁烷 |
②2Na(s)+O2(g)=Na2O2(s)△H=-511kJ•mol-1
写出Na2O2与单质钠化合成Na2O固体的热化学方程式Na(s)+Na2O2(s)=2Na2O(s)△H=-317 kJ•mol-1.
(4)我国已经立法规定酒驾入列.“酒精检测仪”中有红色CeO3和少量H2SO4,检测酒驾时产物有三价铬和CO2等,该反应的化学方程式为C2H5OH+4CrO3+6H2SO4=2Cr2(SO4)3+2CO2↑+9H2O.
| A. | 任何化学反应的限度都相同 | |
| B. | 可以通过改变温度控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| D. | 当一个化学反应在一定条件下达到最大限度时,反应速率也最大 |
| A. | $\frac{a}{A+m}$(A-N+m)mol | B. | $\frac{a}{Am}$(A-N)mol | C. | $\frac{a}{A+m}$(A-N)mol | D. | $\frac{a}{A}$(A-N+m)mol |
 X、Y、Z、W、Q是原子序数依次增大的前四周期元素.已知X、Y、Z、W均为非金属元素,X的基态原子由2个未成对电子,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:
X、Y、Z、W、Q是原子序数依次增大的前四周期元素.已知X、Y、Z、W均为非金属元素,X的基态原子由2个未成对电子,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题: ;
;