题目内容
15.下列说法正确的是( )| A. | 最外层电子排布为ns2的元素一定处于周期表IIA族 | |
| B. | 互为手性异构体的分子互为镜像 | |
| C. | SO2、SO3都是极性分子 | |
| D. | 在晶体中有阳离子一定就有阴离子 |
分析 A.原子最外层电子数为2的元素有He、第ⅡA族元素、第ⅡB族元素等;
B.互为手性异构体的分子如同左右手一样互为镜像;
C.SO2是极性分子,而SO3都是非极性分子;
D.金属晶体中含有阳离子但无阴离子.
解答 解:A.最外层电子排布为ns2的元素有He、第ⅡA族元素、第ⅡB族元素等,不一定为IIA族,故A错误;
B.互为手性异构体的分子如同左右手一样互为镜像,故B正确;
C.SO2是极性分子,而SO3都是非极性分子,故C错误;
D.金属晶体中含有阳离子但无阴离子,故D错误;
故选B.
点评 本题考查元素周期表、手性异构体的性质、分子的极性和晶体的构成微粒等,难度不大,注意具有完全相同的组成和原子排列的一对分子,如同左右手一样互为镜像,确在三维空间里不能重叠,互称手性异构.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.${\;}_{6}^{13}$C-NMR(核磁共振)可用于含碳化合物的结构分析.下列有关${\;}_{6}^{13}$C的说法正确的是( )
| A. | ${\;}_{6}^{13}$C的质量数是13,原子序数是6,核内有6个中子 | |
| B. | ${\;}_{6}^{13}$C的是碳的一种核素,与${\;}_{6}^{12}$C互为同位素 | |
| C. | 碳元素的相对原子质量为13 | |
| D. | ${\;}_{6}^{13}$C的与金刚石、石墨、C60等互为同素异形体 |
3.1999年是人造元素丰收年,一年间得到了核电荷数分别为114、116和118三种新元素,已知核电荷数为118的新元素的一种原子的质量数为293,则该原子中子与电子数之差为( )
| A. | 0 | B. | 57 | C. | 118 | D. | 175 |
10.下列表达式错误的是( )
| A. | 甲烷的电子式: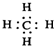 | |
| B. | 氮原子的L层电子的电子排布图: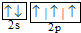 | |
| C. | 碳-12原子:${\;}_{6}^{12}$C | |
| D. | S2-的核外电子排布式:1s22s22p63s23p4 |
20.下列反应既属于非氧化还原反应,又属于吸热反应的是( )
| A. | 铝片和稀盐酸反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 甲烷在氧气中的燃烧 |
7.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
| A. | x的原子半径大于y的原子半径 | |
| B. | x的第一电离能小于y 的第一电离能 | |
| C. | x阴离子的半径小于y阳离子的半径 | |
| D. | x的电负性大于y的电负性 |
5.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A. | 原子半径的大小顺序为:rZ>rW>rY>rX | |
| B. | 离子Y2-和X3-的核外电子数和电子层数都不相同 | |
| C. | 物质WY2、WZ4均有熔点高、硬度大的特性 | |
| D. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |



