题目内容
17.常温下,关于pH=2的盐酸溶液的说法错误的是( )| A. | 溶液中c(H+)=1.0×10-2 mol/L | |
| B. | 此溶液中由水电离出的c(OH-)=1.0×10-12 mol/L | |
| C. | 加水稀释100倍后,溶液的pH=4 | |
| D. | 加入等体积pH=12的氨水,溶液呈酸性 |
分析 A、pH=2的盐酸溶液,说明溶液中c(H+)=1.0×10-2 mol/L;
B、根据Kw=c(H+)•c(OH-)=1.0×10-14 mol/L,分析求解;
C、加水稀释100倍后,溶液的pH增加2个单位;
D、PH之和为14的溶液,等体积混合谁弱显谁性.
解答 解:A、pH=2的盐酸溶液,说明溶液中c(H+)=1.0×10-2 mol/L,故A正确;
B、根据Kw=c(H+)•c(OH-)=1.0×10-14 mol/L,所以c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-2}}$=1.0×10-12 mol/L,故B正确;
C、加水稀释100倍后,溶液的pH增加2个单位,所以溶液的PH=2+2=4,故C正确;
D、PH之和为14的溶液,等体积混合谁弱显谁性,氨水是弱碱,所以溶液呈碱性,故D错误;
故选D.
点评 本题考查了酸碱混合后定性判断及溶液酸碱性与溶液pH的简单计算,题目难度不大,注意掌握溶液酸碱性与溶液pH的计算方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
12.下列实验操作正确的是( )
| A. | 向放有电石的圆底烧瓶中,滴入饱和食盐水可产生乙炔气体 | |
| B. | 实验室制乙烯时,若实验中途发现忘记加碎瓷片,可马上加入,但在加入时一定要缓慢打开塞子,小心操作 | |
| C. | 将2%的NaOH溶液4~5滴,滴入2 mL 10%的CuSO4溶液中制得Cu(OH)2悬浊液,加入乙醛溶液加热,用以检验醛基存在 | |
| D. | 将卤代烃加入到热氢氧化钠溶液中一段时间后,取上层液体,加入AgNO3液产生沉淀,则证明卤代烃中含有卤元素 |
8.最近,国际机构正在给第113号元素进行命名,该元素的某种原子有一个“巨大”的原子核,包含113个质子和173个中子.关于该原子的说法错误的是( )
| A. | 核电荷数为113 | B. | 质量数为286 | C. | 核外电子数为173 | D. | 化学性质不稳定 |
5.能够产生如图实验现象的液体是( )


| A. | CS2 | B. | CCl4 | C. | H2O | D. |  |
12.同素异形体指的是同种元素形成的不同结构的单质,它描述的对象是单质.则同分异构体、同位素、同系物描述的对象依次为( )
| A. | 化合物、原子、化合物 | B. | 有机物、单质、化合物 | ||
| C. | 无机化合物、元素、有机化合物 | D. | 化合物、原子、无机化合物 |
2.a L(标准状况)CO2通入100mL 3mol/L NaOH溶液的反应过程中所发生的离子方程式错误的是( )
| A. | a=3.36时,CO2+2OH-→CO32-+H2O | |
| B. | a=4.48时,2CO2+3OH-→CO32-+HCO3-+H2O | |
| C. | a=5.60时,3CO2+4OH-→CO32-+2HCO3-+H2O | |
| D. | a=6.72时,CO2+OH-→HCO3- |
9.下列化学用语正确的是( )
| A. | CH3OOCCH3名称为甲酸乙酯 | |
| B. | 次氯酸的电子式  | |
| C. | 17Cl原子3p亚层有一个未成对电子 | |
| D. | 碳原子最外层电子云有两种不同的伸展方向 |
6.不能用于比较Na与Al金属性相对强弱的事实是( )
| A. | 最高价氧化物对应水化物的碱性强弱 | |
| B. | Na和AlCl3溶液反应 | |
| C. | 单质与H2O反应的难易程度 | |
| D. | 比较同浓度NaCl和AlCl3的pH大小 |
7.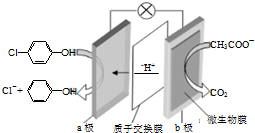 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚( 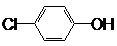 ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )
 现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(
现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(  ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )| A. | b为电池的正极,发生还原反应 | |
| B. | 电流从b极经导线、小灯泡流向a极+2e-+H+=Cl-+ | |
| C. | a极的电极反应式为: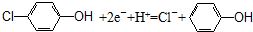 | |
| D. | 当外电路中有0.2mole-转移时,a极区增加的H+的个数为0.2NA |