题目内容
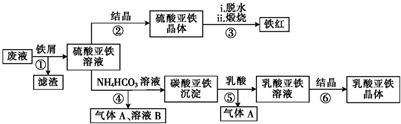
15.以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);I.从废液中提纯并结晶处FeSO4•7H2O.
Ⅱ.将FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液
Ⅲ.将浊液过滤,用90°C热水洗涤沉淀,干燥后得到FeCO3固体
Ⅳ.煅烧FeCO3,得到Fe2O3固体
已知:NH4HCO在热水中分解
(1)I中,加足量的铁屑出去废液中的Fe3+,该反应的离子方程式是Fe+2Fe3+=3Fe2+
(2)Ⅲ中,生成FeCO3的离子方程式是Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是4FeCO3+O2+6H2O=4CO2↑+4Fe(OH)3.
(3)Ⅵ中,通过检验SO${\;}_{4}^{2-}$来判断沉淀是否洗涤干净.检验SO${\;}_{4}^{2-}$操作是取少量洗涤后的试液放入试管中,滴加酸化的氯化钡溶液,若无白色沉淀生成,则沉淀洗涤干净
(4)已知煅烧FeCO3的化学方程式是FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,现煅烧464.0kg的FeCO3,得到316.8kg产品,若产品中杂质只有FeO,则该产品中Fe2CO3的质量是288.0kg(摩尔质量/g•mol-1:FeCO3-116 Fe2CO3-160 FEO-72)
分析 (1)Fe可以和三价铁反应生成亚铁离子;
(2)亚铁离子和碳酸氢根离子相互促进水解生成碳酸亚铁和二氧化碳,亚铁离子易被氧气氧化为三价铁;
(3)根据硫酸根离子可以和钡离子反应生成不溶于硝酸的白色沉淀来检验硫酸根离子;
(4)根据含铁元素物质的质量关系来计算.
解答 解:(1)Fe可以和三价铁反应生成亚铁离子,即Fe+2Fe3+=3Fe2+,
故答案为:Fe+2Fe3+=3Fe2+;
(2)FeSO4溶液与稍过量的NH4HCO3溶液混合,亚铁离子和碳酸氢根离子双水解生成碳酸亚铁和二氧化碳,即Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,生成的碳酸亚铁中,亚铁离子易被氧气氧化为三价铁,即4FeCO3+O2+6H2O=4CO2↑+4Fe(OH)3,
故答案为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;4FeCO3+O2+6H2O=4CO2↑+4Fe(OH)3;
(3)硫酸根离子可以和钡离子反应生成不溶于硝酸的白色沉淀,检验硫酸根是否存在可以验证沉淀是否洗净,具体做法是:少量洗涤后的试液放入试管中,滴加酸化的氯化钡溶液,若无白色沉淀生成,则沉淀洗涤干净,
故答案为:取少量洗涤后的试液放入试管中,滴加酸化的氯化钡溶液,若无白色沉淀生成,则沉淀洗涤干净;
(4)假设Fe2O3物质的量为x mol,FeO的物质的量为y mol,那么满足:160x+72y=316800;(2x+y)×116=464000,解得x=1800mol,所以产物中Fe2O3的质量160g/mol×1800mol=288000g=288kg,
故答案为:288.0.
点评 本题考查学生铁元素的不同价态之间的转化,可以根据所学知识进行回答,难度较大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
19.有一种白色固体,由下列四种物质中的两种混合而成:①NaCl; ②K2SO4;③Na2CO3;④BaCl2.把这白色粉末加水搅拌,有白色不溶物.过滤,经检验滤液中只含K+和Cl-两种离子,则可判断白色粉末是( )
| A. | 由①和②混合 | B. | 由③和④混合 | C. | 由②和④混合 | D. | 由②和③混合 |
4.一定条件下,在一密闭容器中通人一定量SO2和O2的混合气,发生如下反应:2SO2(g)+O2(g)?2SO3(g)(正反应为放热反应).反应达平衡后SO2、O2和SO3的物质的量之比为3:4:6,若保持其他条件不变,降低温度后达到新的平衡时,O2和SO3的物质的量分别为1.1mol和2.0mol,则此时容器内SO2的物质的量应是( )
| A. | 0.7 mol | B. | 0.9 mol | C. | 1.1 mol | D. | 1.3 mol |
5.下列物质分类正确的是( )
| A. | HCl、纯碱、硫酸钡均为强电解质 | |
| B. | SO2、SiO2、CO均为酸性氧化物 | |
| C. | 稀豆浆、油水、氯化铁溶液均为胶体 | |
| D. | 大理石、CuSO4•5H2O、氨水均为混合物 |

 苯与液溴制取溴苯
苯与液溴制取溴苯 反应类型:取代反应
反应类型:取代反应