题目内容
已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ?mol-1;HCl(aq)与NaOH(aq)中和反应的△H=-55.6kJ?mol-1.则HCN在水溶液中电离的△H等于( )
分析:利用盖斯定律进行计算,分别写出两个反应的热化学方程式,将两个热化学方程式相加(减)得到HCN在水溶液中电离的电离方程式,同时反应热也随之相加(减),可得HCN在水溶液中电离的反应热.
解答:解:反应的热化学方程式分别为:
HCN(aq)+OH-(aq)═CN-(aq)+H2O(l)△H=-12.1kJ?mol-1…①
H+(aq)+OH-(aq)═H2O(l)△H=-55.6kJ?mol-1…②
HCN电离方程式为,HCN H++CN-,用①-②可得HCN电离的热化学方程式为:
H++CN-,用①-②可得HCN电离的热化学方程式为:
HCN(aq) H+(aq)+CN-(aq)△H=-12.1kJ?mol-1-(-55.6kJ?mol-1)=+43.5kJ?mol-1,
H+(aq)+CN-(aq)△H=-12.1kJ?mol-1-(-55.6kJ?mol-1)=+43.5kJ?mol-1,
故选A.
HCN(aq)+OH-(aq)═CN-(aq)+H2O(l)△H=-12.1kJ?mol-1…①
H+(aq)+OH-(aq)═H2O(l)△H=-55.6kJ?mol-1…②
HCN电离方程式为,HCN
 H++CN-,用①-②可得HCN电离的热化学方程式为:
H++CN-,用①-②可得HCN电离的热化学方程式为:HCN(aq)
 H+(aq)+CN-(aq)△H=-12.1kJ?mol-1-(-55.6kJ?mol-1)=+43.5kJ?mol-1,
H+(aq)+CN-(aq)△H=-12.1kJ?mol-1-(-55.6kJ?mol-1)=+43.5kJ?mol-1,故选A.
点评:本题考查反应热的计算,本题难度不大,做题时注意盖斯定律的应用方法.

练习册系列答案
相关题目
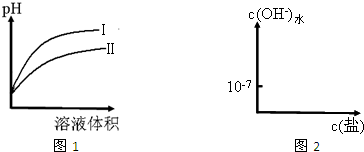
 HSO3-+OH-
HSO3-+OH- H+(aq)+CN-(aq)△H=+43.5kJ?mol-1
H+(aq)+CN-(aq)△H=+43.5kJ?mol-1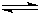 HCN(aq)+OH-(aq)的△H=
HCN(aq)+OH-(aq)的△H= ;HCl(aq)与NaOH反应的
;HCl(aq)与NaOH反应的 ,则HCN在水溶液中电离的
,则HCN在水溶液中电离的 等于
等于
 B.- 43.5
B.- 43.5