题目内容
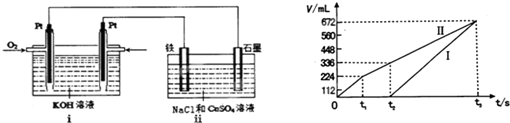
某100mL 混合溶液(含2.0mol/L CuSO4和2.0mol/L NaCl),用惰性电极电解(电解时间充足),试回答下列问题:
(1)阳极的电极反应式 ;阴极的电极反应式 ;
(2)当阴极析出的金属与阳极产生的气体的物质的量相等时(忽略气体在水中的溶解,下同),则析出的金属与产生的气体质量之比可能为 ;
(3)当阴极产生的气体与阳极产生的气体体积相等时(同温同压下测定),则阴极产生的气体是 ,其物质的量是 mol,阳极产生的气体是 ,其物质的量分别是 ,此时溶液中的溶质是 ,其物质的量分别是 ,转移电子总物质的量是 mol.
(1)阳极的电极反应式
(2)当阴极析出的金属与阳极产生的气体的物质的量相等时(忽略气体在水中的溶解,下同),则析出的金属与产生的气体质量之比可能为
(3)当阴极产生的气体与阳极产生的气体体积相等时(同温同压下测定),则阴极产生的气体是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)n(CuSO4)=0.2mol,n(NaCl)=0.2mol,根据题意结合电子守恒,在阴极放电的离子有Cu2+,在阳极放电的离子有Cl-、OH-;
(2)当阴极铜离子全部析出时,析出0.2mol金属Cu,转移0.4mol电子,根据电子守恒,阳极产生的气体为0.1mol氯气和0.05mol氧气,气体总的物质的量为0.15mol,所以当阴极析出的金属与阳极产生的气体的物质的量相等时在阴极放电的离子有Cu2+,在阳极放电的离子有Cl-,或阴极反应:Cu2++2e-=Cu,2H++2e-=H2↑,阳极反应:2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,据此分析解答;
(3)当阴极产生的气体与阳极产生的气体体积相等时,在阴极放电的离子有Cu2+、H+,在阳极放电的离子有Cl-、OH-,根据生成的氢气体积和氯气、氧气的体积和相等分析解答.
(2)当阴极铜离子全部析出时,析出0.2mol金属Cu,转移0.4mol电子,根据电子守恒,阳极产生的气体为0.1mol氯气和0.05mol氧气,气体总的物质的量为0.15mol,所以当阴极析出的金属与阳极产生的气体的物质的量相等时在阴极放电的离子有Cu2+,在阳极放电的离子有Cl-,或阴极反应:Cu2++2e-=Cu,2H++2e-=H2↑,阳极反应:2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,据此分析解答;
(3)当阴极产生的气体与阳极产生的气体体积相等时,在阴极放电的离子有Cu2+、H+,在阳极放电的离子有Cl-、OH-,根据生成的氢气体积和氯气、氧气的体积和相等分析解答.
解答:
解:100mL 混合溶液(含2.0mol/L CuSO4和2.0mol/L NaCl),n(NaCl)=0.2mol,n(CuSO4)=0.2mol.
(1)在阴极的离子有Cu2+、H+,在阳极的离子有Cl-、OH-,n(CuSO4)=0.2mol,Cu2+反应完需转移4mol电子,阴极发生Cu2++2e-=Cu,根据电子守恒,此时阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,
故答案为:2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O;Cu2++2e-=Cu;
(2)当阴极铜离子全部析出时,析出0.2mol金属Cu,转移0.4mol电子,根据电子守恒,阳极产生的气体为0.1mol氯气和0.05mol氧气,气体总的物质的量为0.15mol,所以当阴极析出的金属与阳极产生的气体的物质的量相等时在阴极放电的离子有Cu2+,Cu2++2e-=Cu,在阳极放电的离子有Cl-,2Cl--2e-=Cl2↑,则析出的金属与产生的气体质量之比可能为1:1,也可能为:阴极反应:Cu2++2e-=Cu,2H++2e-=H2↑,当阴极铜离子全部析出时,析出0.2mol金属Cu,转移0.4mol电子,当阴极析出的金属与阳极产生的气体的物质的量相等时阳极反应:2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,生成0.1mol氯气和0.1mol氧气转移0.6mol电子,说明阴极反应:2H++2e-=H2↑,生成0.1mol氢气;则析出的金属与产生的气体质量之比为0.2mol:(0.2mol+0.1mol)=2:3,
故答案为:1:1或2:3;
(3)阴极产生的气体与阳极产生的气体体积相等,说明阴极反应:Cu2++2e-=Cu,2H++2e-=H2↑,阳极反应:2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,
设析出xmolH2生成,根据电子守恒,阳极产生的气体为0.1mol氯气和(x-0.1)mol氧气,则0.2×2+2x=0.1mol×2+(x-0.1)×4,解得:x=0.3mol,
则则阴极产生的气体是H2其物质的量是0.3mol,阳极产生的气体为0.1mol氯气和0.2mol氧气,此时溶液中剩余0.2mol氢离子、0.2mol硫酸根离子、0.2mol钠离子,所以此时溶液中的溶质是0.1molH2SO4、0.1molNa2SO4,转移电子总物质的量是0.2×2+2x=0.4+2×0.3=1mol,
故答案为:H2;0.3;Cl2、O2;0.1mol、0.2mol;H2SO4、Na2SO4;0.1mol、0.1mol;1mol;
(1)在阴极的离子有Cu2+、H+,在阳极的离子有Cl-、OH-,n(CuSO4)=0.2mol,Cu2+反应完需转移4mol电子,阴极发生Cu2++2e-=Cu,根据电子守恒,此时阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,
故答案为:2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O;Cu2++2e-=Cu;
(2)当阴极铜离子全部析出时,析出0.2mol金属Cu,转移0.4mol电子,根据电子守恒,阳极产生的气体为0.1mol氯气和0.05mol氧气,气体总的物质的量为0.15mol,所以当阴极析出的金属与阳极产生的气体的物质的量相等时在阴极放电的离子有Cu2+,Cu2++2e-=Cu,在阳极放电的离子有Cl-,2Cl--2e-=Cl2↑,则析出的金属与产生的气体质量之比可能为1:1,也可能为:阴极反应:Cu2++2e-=Cu,2H++2e-=H2↑,当阴极铜离子全部析出时,析出0.2mol金属Cu,转移0.4mol电子,当阴极析出的金属与阳极产生的气体的物质的量相等时阳极反应:2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,生成0.1mol氯气和0.1mol氧气转移0.6mol电子,说明阴极反应:2H++2e-=H2↑,生成0.1mol氢气;则析出的金属与产生的气体质量之比为0.2mol:(0.2mol+0.1mol)=2:3,
故答案为:1:1或2:3;
(3)阴极产生的气体与阳极产生的气体体积相等,说明阴极反应:Cu2++2e-=Cu,2H++2e-=H2↑,阳极反应:2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,
设析出xmolH2生成,根据电子守恒,阳极产生的气体为0.1mol氯气和(x-0.1)mol氧气,则0.2×2+2x=0.1mol×2+(x-0.1)×4,解得:x=0.3mol,
则则阴极产生的气体是H2其物质的量是0.3mol,阳极产生的气体为0.1mol氯气和0.2mol氧气,此时溶液中剩余0.2mol氢离子、0.2mol硫酸根离子、0.2mol钠离子,所以此时溶液中的溶质是0.1molH2SO4、0.1molNa2SO4,转移电子总物质的量是0.2×2+2x=0.4+2×0.3=1mol,
故答案为:H2;0.3;Cl2、O2;0.1mol、0.2mol;H2SO4、Na2SO4;0.1mol、0.1mol;1mol;
点评:本题考查学生电解原理的知识,明确发生的电极反应、注意电解池两极转移电子数相等的电子守恒思想的运用是解答本题的关键,注意把握电极反应式的书写,题目难度较大.

练习册系列答案
相关题目
可溶性化合物A、B、C由下表中离子组合而成(每种离子只存在于一种化合物中).
现将等物质的量的A、B、C一起溶于水后,所得混合溶液中除H+、OH-外还含有五离子.则A的化学式不可能是( )
| 阳离子 | Mg2+、Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
| A、AgNO3 |
| B、Na2SO4 |
| C、MgCl2 |
| D、MgSO4 |
对于同位素的概念,下列叙述中正确的是( )
| A、原子序数相等,化学性质与质量数不同 |
| B、原子序数相等,并有相同的化学性质和相同的质量数 |
| C、原子序数相等,化学性质几乎完全相同,而中子数不同 |
| D、化学性质相同,而质量数与原子序数不同 |
 A、B、C、D、E为五种原子序数逐渐增大的短周期元素,其中 A与B组成的化合物是一种温室气体,B与D、C与D组成的化合物是机动车排出的大气污染物,D和E能形成原子个数比为1:1和1:2的两种离子化合物.
A、B、C、D、E为五种原子序数逐渐增大的短周期元素,其中 A与B组成的化合物是一种温室气体,B与D、C与D组成的化合物是机动车排出的大气污染物,D和E能形成原子个数比为1:1和1:2的两种离子化合物.