��Ŀ����
��1mol CO��1mol H2O(g)����ij�̶��ݻ��ķ�Ӧ���У���ij�����´ﵽƽ�⣺
CO��H2O(g) CO2��H2��
CO2��H2��
��ʱ��2/3��COת��ΪCO2��
(1)��ƽ��������CO2���������Ϊ________��
(2)������ͬ�����£��������г���1mol CO2��1mol H2��1mol H2O����ﵽƽ��ʱ��(1)��ƽ����Ƚϣ�ƽ��Ӧ��________(�����Ӧ�������淴Ӧ������)�ƶ�����ʱƽ��������CO2������������������и�ֵ�е�________��(����)
[����]
(3)���(2)�м�����������ƽ�����������ƶ�ʱ��������˵������ȷ����________��(�����)
��������IJ���һ������
����������������һ������
�۷�Ӧ���ת����һ������
�ܷ�Ӧ���Ũ��һ������
������Ӧ����һ�������淴Ӧ����
��һ��ʹ���˴���
������
|
����(1)33.3��;(2)����Ӧ����,B;(3)�٢� �������⣺(2)�е�Ͷ���൱��Ͷ����CO 1mol��H2O 1mol��������H2O��Ũ�ȣ�ƽ�����������ƶ�������CO��ת����������ʱ�����ü���˼ά�ķ�������CO��ֻ��2/3ת��������ɵ�ƽ��������CO2���������Ϊ22.2������COȫ��ת��������ɵ�CO2���������Ϊ33.3�������ʵ�����Ӧ���ڶ���֮�䣮 |

 53���ò�ϵ�д�
53���ò�ϵ�д���һ���¶��£���1mol CO��1 molˮ���������ܱ������з�Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g)���ﵽƽ����CO2Ϊ0.6mol����ͨ��4molˮ�������ﵽ��ƽ���CO2���ʵ�����
CO2(g)��H2(g)���ﵽƽ����CO2Ϊ0.6mol����ͨ��4molˮ�������ﵽ��ƽ���CO2���ʵ�����
[����]
|
A������0.6mol |
B������1mol |
|
C������0.6mol����1mol |
D����1mol |
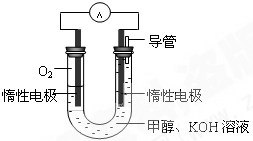 �״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�ã�
�״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�ã� CH3OH��g����H1
CH3OH��g����H1 CH3OH��g��+H2O��g����H2
CH3OH��g��+H2O��g����H2 ��2013?��������ģ����Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��2013?��������ģ����Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����