题目内容
4.某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、NH4+、Cl-、CO32-和SO42-.现每次取100.00mL进行实验:(已知:)①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体0.896L(标准状况下)
③第三份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g.请回答:
(1)c(CO32-)=0.2mol/Lmol/L;
(2)K+是否存在?存在;
(3)根据以上实验,不能判断(填离子符号)是否存在.若存在此离子,如何进行检验?取少量原试液,加足量硝酸钡溶液过滤,取滤液加足量稀硝酸和硝酸银溶液,若有沉淀证明存在氯离子,否则无氯离子.
分析 先根据实验现象判断溶液中存在的离子,不存在的离子,可能存在的离子.
(1)先判断③中酸洗涤前后质量减少的量的成分,再根据减少的沉淀的量计算碳酸根离子的浓度;
(2)先确定实验③中酸洗后沉淀的成分,计算硫酸根离子的物质的量,根据氨气的体积计算铵根离子的物质的量,再根据溶液中阴阳离子所带电荷相等,判断钾离子是否存在;
(3)根据实验现象判断;根据氯离子的检验方法检验,但先判断硫酸根离子的干扰.
解答 解:根据实验①现象判断:该溶液中可能含有Cl-、CO32-、SO42-,
根据实验②现象:有气体无沉淀,该溶液中不含Mg2+,含有NH4+,
根据实验③现象:产生沉淀,部分沉淀溶于盐酸,说明沉淀既有硫酸钡又有碳酸钡,则该溶液中含有CO32-和SO42-离子,
(1)根据实验③现象,酸洗涤沉淀前后,质量减少,减少的质量为碳酸钡的质量,
Ba2++CO32-=BaCO3↓
1mol 197g
0.02mol (6.27-2.33)g
碳酸根的物质的量浓度=$\frac{n}{V}$=0.2mol/L,
故答案为:0.2mol/L;
(2)根据实验③现象,酸洗涤沉淀后沉淀的质量为硫酸钡的质量,
Ba2++SO42-=BaSO4↓
1mol 233g
0.01mol 2.33g
实验②铵根与氢氧根反应产生氨气,
NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
1mol 22.4L
0.04mol 0.896L
则硫酸根的物质的量为0.01mol,铵根离子的物质的量为0.04mol,根据溶液中阴阳离子所带电荷相等得,假设钾离子存在,氯离子不存在,一个硫酸根离子、一个碳酸根离子都各带两个单位的负电荷,一个铵根离子、一个钾离子各带一个单位的正电荷,设其物质的量为xmol,根据溶液中阴阳离子所带电荷相等列方程式,0.02mol×2+0.01mol×2=0.04m0l×1+xmol×1,x=0.02,钾离子的物质的量浓度=$\frac{n}{V}$=0.2mol/L,若溶液中存在氯离子,钾离子的浓度会大于0.2mol/L,则证明钾离子一定存在,
故答案为:存在;
(3)根据实验①现象判断,不能判断氯离子是否存在;氯离子和银离子反应生成白色沉淀,且该沉淀不溶于水和硝酸,所以可用硝酸酸化的硝酸银溶液检验,但先判断硫酸根离子的干扰,
故答案为:不能判断氯离子是否存在;取少量原试液,加足量硝酸钡溶液过滤,取滤液加足量稀硝酸和硝酸银溶液,若有沉淀证明存在氯离子,否则无氯离子.
点评 本题考查了离子的检验方法和离子共存知识,把握实验中发生的反应、现象与结论的关系为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | CH3Cl | B. | CH2Cl2 | C. | CCl4 | D. | HCl |
| A. | 阳极反应式为:Ce2O3-2e-+6H+═2Ce4++3H2O | |
| B. | 电解时溶液中的阳离子向阳极移动 | |
| C. | 如果阴极液是稀硫酸,电极反应式为:2H++2e-═H2↑ | |
| D. | 如果阴极液是钠、镁、铜、镍、锰、锌等的硫酸盐溶液,则在阴极室可得到铜、镍、锌、锰等金属合金粉末 |
| A. | 容器内的总压强不随时间而变化 | |
| B. | 2v正(A2)=v逆(AB) | |
| C. | 单位时间内生成2n mol AB的同时,生成n mol B2 | |
| D. | A2、B2、AB的反应速率之比为1:1:2 |
| A. | 浓硝酸保存在无色的玻璃瓶中 | |
| B. | 氯水应保存在带橡胶塞的棕色细口瓶中 | |
| C. | 金属钠应保存在汽油中防止被氧化 | |
| D. | 保存硫酸亚铁溶液时可向里面加少量铁屑 |

| A. | X显酸性 | B. | Y一定是水 | ||
| C. | Z可能是碳酸钠溶液 | D. | Z可使石蕊试液变蓝 |
| A. | 40mL 1 mol•L-1的稀硝酸溶液 | B. | 40mL 0.5 mol•L-1的稀硫酸溶液 | ||
| C. | 40mL 1 mol•L-1的FeCl3溶液 | D. | 60mL 0.5 mol•L-1的稀盐酸 |
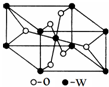 海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.(1)Fe2+的核外电子排布式是[Ar]3d6或1s22s22p63s23p63d6.
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,主要原因是气态Cu失去一个电子变成结构为[Ar]3d10的Cu+,能量较低,所以Cu的第二电离能相对较大(或气态Zn失去一个电子变成结构为[Ar]3d104s1的Zn+,易再失去一个电子,所以Zn的第二电离能相对较小).
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
A.电负性:N>O>S>C
B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化
D.CO、H2S、HCN都是极性分子
(4)CH4与元素X的一种含氢粒子互为等电子体,元素X的这种含氢粒子的化学式是NH4+.
(5)W的原子序数为22,它的一种氧化物晶胞结构如图所示,该氧化物的化学式为TiO2.
(6)在浓的WCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为WCl3•6H2O的绿色晶体,该晶体中两种配位体的物质的量之比为1:5,则该配合物的化学式为[TiCl(H2O)5]Cl2•H2O.