题目内容
A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性.下述为相关实验步骤和实验现象:
请回答: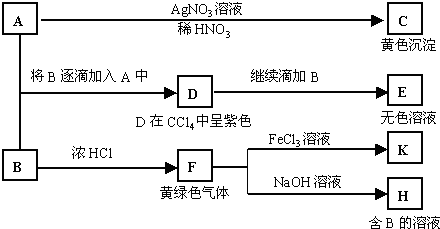
(1)写出A、B和C的化学式:
A ,B ,C .
(2)D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式: .
(3)写出将SO2气体通入K溶液中发生反应的离子方程式: .
H的化学方程式:F→H的化学方程式: .
请回答:

(1)写出A、B和C的化学式:
A
(2)D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
H的化学方程式:F→H的化学方程式:
考点:无机物的推断
专题:推断题
分析:根据图示可以明显看出,黄色沉淀C是经加AgNO3、稀HNO3生成的,C应是AgI;A是NaI溶液;B溶液显碱性,其碱性应为水解所致,说明B是某弱酸的钠盐,B与浓HCl反应得黄绿色气体Cl2,说明B具有氧化性,B还与NaI反应生成D,D为I2,同样说明B具有氧化性,I2还能被B氧化生成E,当Cl2与NaOH反应时有B生成,可知B是NaClO,E中所含的+5价元素的含氧酸根必是IO3-.
解答:
解:钠盐A能和AgNO3溶液反应生成一种难溶于HNO3的黄色沉淀,可确定A为NaI,C为AgI;黄绿色气体F是Cl2;F和NaOH溶液反应生成钠盐B,根据B呈碱性并具有氧化性,可知B为NaClO(NaCl、NaClO3溶液均呈中性);NaClO具有强氧化性,能氧化NaI,少量NaClO将NaI氧化成I2,进一步反应生成NaIO3,其中I为+5价;Cl2氧化FeCl2生成FeCl3,FeCl3又能氧化SO2生成SO42-,则
(1)由以上分析可知A为NaI,B为NaClO,C为AgI,故答案为:NaI;NaClO;AgI;
(2)NaClO具有强氧化性,能氧化NaI,少量NaClO将NaI氧化成I2,反应的离子方程式为2I-+ClO-+H2O=I2+Cl-+2OH-,进一步反应可把I2氧化为NaIO3,反应的离子方程式为I2+5ClO-+2OH-=2IO3-+5Cl-+H2O,
故答案为:2I-+ClO-+H2O=I2+Cl-+2OH-,I2+5ClO-+2OH-=2IO3-+5Cl-+H2O;
(3)FeCl3能氧化SO2生成SO42-,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,F→H为Cl2与NaOH的反应,反应的方程式为Cl2+2NaOH=NaClO+NaCl+H2O,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;Cl2+2NaOH=NaClO+NaCl+H2O.
(1)由以上分析可知A为NaI,B为NaClO,C为AgI,故答案为:NaI;NaClO;AgI;
(2)NaClO具有强氧化性,能氧化NaI,少量NaClO将NaI氧化成I2,反应的离子方程式为2I-+ClO-+H2O=I2+Cl-+2OH-,进一步反应可把I2氧化为NaIO3,反应的离子方程式为I2+5ClO-+2OH-=2IO3-+5Cl-+H2O,
故答案为:2I-+ClO-+H2O=I2+Cl-+2OH-,I2+5ClO-+2OH-=2IO3-+5Cl-+H2O;
(3)FeCl3能氧化SO2生成SO42-,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,F→H为Cl2与NaOH的反应,反应的方程式为Cl2+2NaOH=NaClO+NaCl+H2O,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;Cl2+2NaOH=NaClO+NaCl+H2O.
点评:本题考查无机物的推断,题目难度中等,此题解题突破口为几种物质的颜色,由此可知为卤素单质及其化合物之间的相互转变,答题时注意体会.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
在一定温度、恒容条件下,可逆反应:A2(g)+B2(g)?2AB(g)+C(s) 达到化学平衡的标志是( )
| A、单位时间生成nmol的C,同时生成2nmol 的AB |
| B、容器内的总压,不随时间变化 |
| C、容器内气体密度不变 |
| D、单位时间生成n mol的A2,同时生成n mol的B2 |
近两年流行喝苹果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构式为  ,下列说法不正确的是( )
,下列说法不正确的是( )
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A、苹果酸在一定条件下能发生酯化反应 |
| B、苹果酸在一定条件下能发生催化氧化反应 |
| C、苹果酸在一定条件下能发生加成反应 |
| D、1 mol苹果酸与Na2CO3溶液反应最多生成2 mol CO2 |
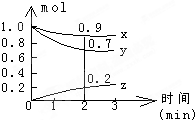 某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:


 (1)现有以下物质:
(1)现有以下物质: A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体.
A~G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体.