题目内容
 如图为一种广泛使用的高分子材料助剂的结构简式,下列说法正确的是(CH3CH2CH2CH3可表示为
如图为一种广泛使用的高分子材料助剂的结构简式,下列说法正确的是(CH3CH2CH2CH3可表示为 )( )
)( )| A、该有机物的分子式为C24H40O4 |
| B、1mol该有机物与氢气发生加成反应,最多消耗5mol氢气 |
| C、该有机物在氢氧化钠作用下发生水解反应得到三种有机物 |
| D、该有机物在FeBr3存在下与液溴发生取代反应生成两种一溴代物 |
考点:有机物的结构和性质
专题:有机物的化学性质及推断
分析:由结构简式可知分子式,分子中含苯环及2个-COOC-,结合苯及酯性质来解答.
解答:
解:A.由结构简式可知分子式为C24H38O4,故A错误;
B.只有苯环与氢气发生加成,则1mol该有机物与氢气发生加成反应,最多消耗3mol氢气,故B错误;
C.该物质结构对称,在氢氧化钠作用下发生水解反应得到2种有机物,分别为邻苯二甲酸钠、2-乙基-1-己醇,故C错误;
D.苯环上只有2种位置的H,则该有机物在FeBr3存在下与液溴发生取代反应生成两种一溴代物,故D正确;
故选D.
B.只有苯环与氢气发生加成,则1mol该有机物与氢气发生加成反应,最多消耗3mol氢气,故B错误;
C.该物质结构对称,在氢氧化钠作用下发生水解反应得到2种有机物,分别为邻苯二甲酸钠、2-乙基-1-己醇,故C错误;
D.苯环上只有2种位置的H,则该有机物在FeBr3存在下与液溴发生取代反应生成两种一溴代物,故D正确;
故选D.
点评:本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酯、苯性质的考查,选项B为易错点,注意结构的对称性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )


| A、a和b分别与电源的负极、正极相连时,电解氯化钠溶液产生氯气 |
| B、a和b用导线连接时,碳棒上发生的反应为:O2+2H2O+4e-→4OH- |
| C、若往溶液中加少许硫酸,无论a和b是否连接,铁片均会溶解,溶液逐渐变成浅绿色 |
| D、若氯化钠溶液改为氯化铵溶液,a和b连接,碳棒上有气泡产生 |
请根据表中化学键的键能计算反应SiCl4(g)+2H2(g)═Si(s)+4HCl(g)的反应热△H为( )
| 化学键 | Si-Cl | H-H | H-Cl | Si-Si |
| 键能/KJ?mol-1 | 360 | 436 | 431 | 176 |
| A、240 | B、412 |
| C、236 | D、667 |
 如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,下列有关说法正确的是( )
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,下列有关说法正确的是( )| A、K与N相接时,能量由电能转化为化学能 |
| B、K与N相接时,H+向Pb电极区迁移 |
| C、K与M连接时,所用电源的a极为正极 |
| D、K与M相接时,阳极附近的pH逐渐减小 |
下列熔合物的固体属于合金的是( )
①Al与Cu ②Fe与C ③K与Na ④Al与Si.
①Al与Cu ②Fe与C ③K与Na ④Al与Si.
| A、①②③④ | B、①③ |
| C、②④ | D、①④ |
在某温度下,可逆反应mA(g)+nB(g)?pC(g)+qD(g)的平衡常数为K,下列说法正确的是( )
| A、平衡常数发生变化,化学平衡必发生移动 |
| B、化学平衡发生移动,平衡常数必发生变化 |
| C、反应物的转化率越大,达到平衡时,K值越大 |
| D、温度越高,达到平衡时,K值越大 |
下列变化过程放热的是( )
| A、H2O(l)→H2O(g) |
| B、2HI(g)→H2(g)+I2(g)+Q Q=-14.9 kJ/mol |
| C、形成化学键时共放出能量862 kJ的化学反应 |
D、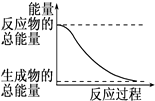 能量变化如图所示的化学反应 |
下列离子方程式正确的是( )
| A、将过量NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++HCO3-+OH-→CaCO3↓+H2O |
| B、Fe(OH)3溶于氢碘酸:2Fe(OH)3+6H++2I-→2Fe2++I2+6H2O |
| C、向硫酸铝铵[NH4Al(SO4)2]溶液中加入氢氧化钡溶液至SO42-离子沉淀完全Al3++2SO42-+2Ba2++4OH-→AlO2-+2BaSO4↓+2H2O |
| D、4mol?L-1的NaAlO2溶液和7mol?L-1的HCl等体积互相均匀混合4AlO2-+7H++H2O→3Al(OH)3↓+Al3+ |