题目内容
2.无机盐X仅由三种短周期元素组成,其相对分子质量为238,原子个数比为1:1:4.将23.8gX与水共热,生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀.请推测并回答:(1)单质A有很强的氧化性,可用于净化空气,饮用水消毒等.A中组成元素的简单离子结构示意图为
 .
.(2)X的化学式Na2S2O8.
(3)实验室可通过低温电解B溶液制备X.该电解反应的化学方程式2NaHSO4$\frac{\underline{\;电解\;}}{低温}$Na2S2O8+H2↑.
(4)X氧化能力强,对环境友好,可用于脱硝、脱硫.在碱性条件下,X氧化NO的离子方程式3S2O82-+2NO+8OH-=6SO42-+2NO3-+4H2O.
(5)X溶液与铜反应时先慢后快.某同学认为除反应放热这一因素外,还有一种可能是反应生成的Cu2+对后续反应起催化作用,为此他设计了如下实验方案:取少量铜粉置于试管中,先加入少量CuSO4溶液,再加入X溶液,振荡,观察现象.若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之Cu2+不起作用.
写出X与铜反应的化学方程式Na2S2O8+Cu=Na2SO4+CuSO4,判断该同学设计的验证方法合理性并说明理由该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42-起催化作用.
分析 无机盐X仅由三种短周期元素组成,其相对分子质量为238,23.8gX的物质的量为$\frac{23.8g}{238g/mol}$=0.1mol,X与水共热生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,B中含有Na元素,则X含有Na元素,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀,白色沉淀为BaSO4,其物质的量为$\frac{46.6g}{233g/mol}$=0.2mol,根据S原子守恒可知X中含有2个S原子,B为NaHSO4,X中三种元素原子个数比为1:1:4,该无机盐X可以表示为(NaSX4)2,则X元素相对原子质量为$\frac{238-(23+32)×2}{4}$=16,则X为O元素,故A为O3,X为Na2S2O8.
解答 解:无机盐X仅由三种短周期元素组成,其相对分子质量为238,23.8gX的物质的量为$\frac{23.8g}{238g/mol}$=0.1mol,X与水共热生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,B中含有Na元素,则X含有Na元素,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀,白色沉淀为BaSO4,其物质的量为$\frac{46.6g}{233g/mol}$=0.2mol,根据S原子守恒可知X中含有2个S原子,B为NaHSO4,X中三种元素原子个数比为1:1:4,该无机盐X可以表示为(NaSX4)2,则X元素相对原子质量为$\frac{238-(23+32)×2}{4}$=16,则X为O元素,故A为O3,X为Na2S2O8.
(1)单质A为O3,组成元素的简单离子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)X的化学式为:Na2S2O8,故答案为:Na2S2O8;
(3)实验室可通过低温电解NaHSO4溶液制备Na2S2O8,该电解反应的化学方程式为:2NaHSO4$\frac{\underline{\;电解\;}}{低温}$Na2S2O8+H2↑,
故答案为:2NaHSO4$\frac{\underline{\;电解\;}}{低温}$Na2S2O8+H2↑;
(4)X氧化能力强,对环境友好,可用于脱硝、脱硫.在碱性条件下,Na2S2O8氧化NO的离子方程式为:3S2O82-+2NO+8OH-=6SO42-+2NO3-+4H2O,
故答案为:3S2O82-+2NO+8OH-=6SO42-+2NO3-+4H2O;
(5)Na2S2O8与铜反应的化学方程式:Na2S2O8+Cu=Na2SO4+CuSO4,该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42-起催化作用,
故答案为:Na2S2O8+Cu=Na2SO4+CuSO4;该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42-起催化作用.
点评 本题考查无机物推断,属于计算型推断,题目素材在中学中比较陌生,侧重考查学生计算能力、分析推理能力、元素化合物知识以及对知识的迁移运用能力,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①卢瑟福的“带核原子模型”
②汤姆生的“葡萄干面包式”
③道尔顿的原子学说
④玻尔的原子结构模型(轨道理论)
| A. | ①③②④ | B. | ③②①④ | C. | ③①②④ | D. | ④③②① |
| A. | 足量CO2通入Na2SiO3溶液:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| B. | 醋酸与NaOH溶液反应:H++OH-═H2O | |
| C. | 氧化镁溶于稀硫酸:MgO+2H+═H2O+Mg2+ | |
| D. | 向AlCl3溶液中加入过量的氨水:Al3++3OH-═Al(OH)3↓ |
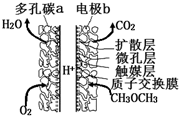 一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )
一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示.下列有关该电池的说法不正确的是( )| A. | 多孔碳a能增大气固接触面积,提高反应速率,该电极为负极 | |
| B. | 电极b上发生的反应为:CH3OCH3-12e-+3H2O═2CO2+12H+ | |
| C. | H+由b电极向a电极迁移 | |
| D. | 二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇(CH3OH)直接燃料电池能量密度的1.4倍 |
| A. | 燃烧大块固体燃料 | B. | 把液体燃料雾化后燃烧 | ||
| C. | 燃烧时空气应不足量 | D. | 燃烧时空气应越多越好 |
| A. | AgCl、AgBr、AgI均是难溶于水的固体,且要避光保存于棕色瓶中 | |
| B. | AgCl是白色难溶于水的固体,用于指纹鉴定有助于警察破案 | |
| C. | AgBr是黑色光敏性物质,常用于制作胶卷和人工降雨 | |
| D. | AgI是黄色固体,见光容易分解为单质碘和黑色的单质银,还常用于人工降雨 |
| A. | 氢氧燃料电池可将热能直接转变为电能 | |
| B. | 铁制品上镀铜时,镀件为阳极,铜盐为电镀液 | |
| C. | 镀锌铁皮的镀层损坏后,铁更容易腐蚀 | |
| D. | 铅蓄电池充电时Pb极与外电源的负极相连 |