题目内容
在25℃时,向稀醋酸中加水稀释,醋酸的电离平衡向哪个方向移动?
答案:
解析:
解析:
醋酸在水溶液中的电离平衡,用电离方程式表示:
|

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
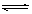 CH3COO-+H+,加少量烧碱溶液可使溶液中
CH3COO-+H+,加少量烧碱溶液可使溶液中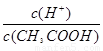 值增大。
值增大。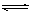 H++OH-逆向移动,c(H+)降低
H++OH-逆向移动,c(H+)降低