题目内容
11.氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业.CuCl难溶于醇和水,在潮湿空气中易水解氧化,且在氯离子浓度较大的体系中存在CuCl+Cl-?[CuCl2]-. 工业上用低品铜矿(主要含CuS、Cu2S、FeO等)制备CuCl的一种工艺流程如图1: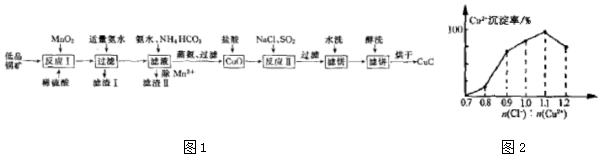
回答下面问题:
(1)反应I中被氧化的元素有S、Cu、Fe(填元素符号)
(2)滤渣II的成分主要为MnCO3,写出除Mn2+的离子方程式Mn2++HCO3-+NH3•H2O═MnCO3↓+NH4++H2O.
(3)写出反应Ⅱ中发生反应的离子方程式SO2+2Cu2++2Cl-+2H2O═2CuCl↓+SO42-+4H+.
(4)在进行反应Ⅱ时,通入的SO2一般都要适当过量,目的是将CuCl2完全转化为CuCl并防止CuCl的氧化.
(5)滤饼进行醇洗的目的醇洗有利于加快除去CuCl表面水分,并防止其水解和氧化.
(6)在进行反应Ⅱ时,当氯化钠用量增加到一定程度后氯化亚铜的沉淀率减小,原因是增大氯离子浓度,CuCl+Cl-?[CuCl2]-,平衡向右移动,使生成的氯化亚铜又部分转化为[CuCl2]-.
(7)Cu2+的沉淀率是指转化为CuCl的n(Cu2+)占总的 n(Cu2+)的百分比.在一定条件下Cu2+沉淀率与沉淀前的Cl-、Cu2+的物质的量之比[n(Cl-):n(Cu2+)]的关系如图2所示,CuCl+Cl-?[CuCl2]-的平衡常数K=6.5×10-2,则该条件下Cu2+的最大沉淀率为99.39%(保留两位小数).
分析 低品铜矿(主要含CuS、Cu2S、FeO等)溶解于稀硫酸和二氧化锰的混合物得到硫酸铁、硫酸铜、及其硫酸锰的混合溶液,滴加适量氨水沉淀溶液中铁离子,过滤得到滤渣Ⅰ为氢氧化铁,滤液中滴加氨水和碳酸氢铵溶液沉淀溶液中锰离子得到滤渣Ⅱ为MnCO3,滤液经蒸氨过滤得到氧化铜,将氧化铜溶解于稀盐酸得到氯化铜溶液,再加入NaCl溶液并通入SO2气体发生反应Ⅱ得到CuCl沉淀,过滤、水洗、醇洗最后烘干得到CuCl,
(1)反应Ⅰ中是CuS、Cu2S、FeO等在酸性条件下被二氧化锰氧化,其中S、Cu、Fe元素分别被氧化为SO42-、Cu2+、Fe3+;
(2)向含锰离子的溶液中滴加氨水和碳酸氢铵溶液沉淀溶液中锰离子得到滤渣Ⅱ为MnCO3;
(3)反应Ⅱ是二氧化硫将铜离子还原生成CuCl,氧化产物为SO42-;
(4)CuCl易被氧化,二氧化硫水溶液具有较强还原性分析;
(5)醇易挥发且CuCl不溶于醇,则用醇洗有利于加快除去CuCl表面水分丙防止其水解和氧化;
(6)CuCl在氯离子浓度较大的体系中存在CuCl+Cl-?[CuCl2]-,增大氯离子浓度平衡正向进行;
(7)设Cu2+的最大沉淀率为x,沉淀率降低前的Cl-、Cu2+的物质的量之比为1.1:1,设Cu2+为1mol,Cl-离子为1.1mol,则生成的CuCl为xmol,剩余Cl-物质的量(1.1-x)mol,当Cu2+为最大沉淀率时,溶液中Cl-接近0.1mol,则生成的[CuCl2]-为(1.1-x-0.1)mol=(1-x)mol,平衡时Cl-为0.1mol-(1-x)mol=(x-0.9)mol,根据平衡计算平衡常数K=$\frac{c([CuC{l}_{2}]^{-})}{c(C{l}^{-})}$=$\frac{1-x}{x-0.9}$=6.5×10-2,计算得到x;
解答 解:低品铜矿(主要含CuS、Cu2S、FeO等)溶解于稀硫酸和二氧化锰的混合物得到硫酸铁、硫酸铜、及其硫酸锰的混合溶液,滴加适量氨水沉淀溶液中铁离子,过滤得到滤渣Ⅰ为氢氧化铁,滤液中滴加氨水和碳酸氢铵溶液沉淀溶液中锰离子得到滤渣Ⅱ为MnCO3,滤液经蒸氨过滤得到氧化铜,将氧化铜溶解于稀盐酸得到氯化铜溶液,再加入NaCl溶液并通入SO2气体发生反应Ⅱ得到CuCl沉淀,过滤、水洗、醇洗最后烘干得到CuCl,
(1)反应Ⅰ中是CuS、Cu2S、FeO等在酸性条件下被二氧化锰氧化,其中S、Cu、Fe元素分别被氧化为SO42-、Cu2+、Fe3+,反应I中被氧化的元素有S、Cu、Fe,
故答案为:S、Cu、Fe;
(2)向含锰离子的溶液中滴加氨水和碳酸氢铵溶液沉淀溶液中锰离子得到滤渣Ⅱ为MnCO3,其反应的离子方程式为:Mn2++HCO3-+NH3•H2O═MnCO3↓+NH4++H2O;
故答案为:Mn2++HCO3-+NH3•H2O═MnCO3↓+NH4++H2O;
(3)反应Ⅱ是二氧化硫将铜离子还原生成CuCl,氧化产物为SO42-,发生反应的离子方程式为:SO2+2Cu2++2Cl-+2H2O═2CuCl↓+SO42-+4H+;
故答案为:SO2+2Cu2++2Cl-+2H2O═2CuCl↓+SO42-+4H+;
(4)CuCl易被氧化,二氧化硫水溶液具有较强还原性,则在进行反应Ⅱ时,通入二氧化硫适当过量,可以将CuCl2完全转化为CuCl并防止CuCl的氧化,
故答案为:将CuCl2完全转化为CuCl并防止CuCl的氧化;
(5)醇易挥发且CuCl不溶于醇,则用醇洗有利于加快除去CuCl表面水分丙防止其水解和氧化,
故答案为:醇洗有利于加快除去CuCl表面水分,并防止其水解和氧化;
(6)CuCl在氯离子浓度较大的体系中存在CuCl+Cl-?[CuCl2]-,增大氯离子浓度,CuCl+Cl-?[CuCl2]-,平衡向右移动,使生成的氯化亚铜又部分转化为[CuCl2]-,
故答案为:增大氯离子浓度,CuCl+Cl-?[CuCl2]-,平衡向右移动,使生成的氯化亚铜又部分转化为[CuCl2]-;
(7)设Cu2+的最大沉淀率为x,沉淀率降低前的Cl-、Cu2+的物质的量之比为1.1:1,设Cu2+为1mol,Cl-离子为1.1mol,则生成的CuCl为xmol,剩余Cl-物质的量(1.1-x)mol,当Cu2+为最大沉淀率时,溶液中Cl-接近0.1mol,则生成的[CuCl2]-为(1.1-x-0.1)mol=(1-x)mol,平衡时Cl-为0.1mol-(1-x)mol=(x-0.9)mol,根据平衡计算平衡常数K=$\frac{c([CuC{l}_{2}]^{-})}{c(C{l}^{-})}$=$\frac{1-x}{x-0.9}$=6.5×10-2,x=99.39%,
故答案为:99.39%.
点评 本题考查了物质分离提纯、物质性质、离子发生的氧化还原反应分析、离子方程式书写、除杂试剂和产物的判断、图象变化实质的理解应用和计算分析.掌握基础是解题关键,题目难度中等.

| A. | CH3CH2OH+HBr$\stackrel{加热}{→}$CH3CH2Br+H2O | |
| B. | C4H10$\stackrel{一定条件}{→}$C2H4+C2H6 | |
| C. | CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2═CH2↑+H2O | |
| D. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O |
| A. | C6H13COOH | B. | C6H5COOH | C. | C7H15COOH | D. | C6H5CH2COOH |
| A. | $\frac{12a}{{N}_{A}b}$ | B. | $\frac{12a}{b}$ | C. | $\frac{12b}{{N}_{A}a}$ | D. | $\frac{a}{{N}_{A}b}$ |
表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算):
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 |
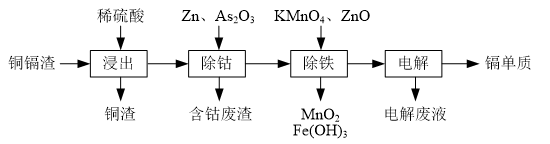
(2)除钴过程中,锌粉会与As2O3形成微电池产生AsH3.该微电池的正极反应式为As2O3+12H++12e-=2AsH3+3H2O.
(3)除铁时先加入适量KMnO4,再加入ZnO调节pH.
①除铁过程中,理论上参加反应的物质n(KMnO4):n(Fe2+)=1:3.
②除铁时加入ZnO控制反应液pH的范围为3.3~7.2.
(4)若上述流程中投入的KMnO4不足量,则待电解溶液中有Fe元素残余.请设计实验方案加以验证:取样,向其中滴加H2O2后再滴入KSCN溶液,若溶液变红(或向其中滴加K3[Fe(CN)6)]溶液,若产生蓝色沉淀),则待电解液中含有Fe元素.
(5)净化后的溶液用惰性电极电解可获得镉单质.电解废液中可循环利用的溶质是H2SO4.
| A. | 75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| B. | 氟利昂化学性质稳定、无毒,但却会引起臭氧层空洞 | |
| C. | 食品饮料中的菠萝酯,只能从菠萝中提取,不能通过有机合成生产 | |
| D. | 洗虾粉的主要成分是草酸,大量摄入草酸会对人体有不良影响,故应该限制使用洗虾粉 |
| A. | 2H2(g)+O2(g)═2H2O(l) | |
| B. | 4Al(s)+3O2(g)═2Al2O3(s) | |
| C. | 2Na(s)+2H2O(l)═2Na+(aq)+2OH- (aq)+H2(g) | |
| D. | 2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH- (aq)═BaSO4(s)+2H2O(l) |
| A. | 氮气、氢气不再化合,氨气不再分解 | |
| B. | 生成2mol氨气的同时,反应了3molH2 | |
| C. | 容器内混合气体的压强不随时间而变化 | |
| D. | 氮气、氢气、氨气的浓度之比为1:3:2 |

 .
. .
.