题目内容
6.6.5g的锌和足量的盐酸反应.(1)计算产生的气体在标准状况下的体积2.24L.(不必写出计算过程)
(2)计算反应过程中转移电子的物质的量.(写出计算过程)
分析 根据n=$\frac{m}{M}$计算6.5g Zn的物质的量,根据方程式:Zn+2HCl=ZnCl2+H2↑,计算生成氢气的物质的量,根据V=nVm计算氢气的体积,结合Zn化合价计算转移电子物质的量.
解答 解:(1)6.5g Zn的物质的量=$\frac{6.5g}{65g/mol}$=0.1mol,
设生成氢气的物质的量为x,则:
Zn+2HCl=ZnCl2+H2↑
1 1
0.1mol x
x=$\frac{0.1mol×1}{1}$=0.1mol
标况下,生成氢气的体积=0.1mol×22.4L/mol=2.24L,
故答案为:2.24L;
(2)反应中Zn由0价升高为+2价,故转移电子为0.1mol×(2-0)=0.2mol,
答:反应中转移电子为0.2mol.
点评 本题考查化学方程式的计算,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
16.在生产和生活中,人们广泛利用着化学反应释放的能量.下列说法正确的是( )
| A. | 有能量变化的都是化学变化 | |
| B. | 物质发生化学变化并不一定都伴随着能量变化 | |
| C. | 用实验方法和理论方法研究反应热的化学称为热化学 | |
| D. | 任何反应中的能量变化都表现为热量变化 |
17.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时应使温度计水银球与蒸馏烧瓶支管口平齐 | |
| C. | 蒸发时,待蒸发皿中没有水了再停止加热 | |
| D. | 称量氢氧化钠时,应先将小烧杯放在左盘称量,再将药品加入到小烧杯中称量 |
14.误食少量含有重金属(Cu2+)的食物会使人中毒,可服用下列哪种物质缓解中毒程度( )
| A. | 生鸡蛋清 | B. | 食盐水 | C. | 糖水 | D. | 白醋 |
1.某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是量筒、温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?不能(填“能”或“否”),其原因是金属易导热,热量散失导致误差大.
(3)他们记录的实验数据如下:
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18J•℃-1•g-1,各物质的密度均为1g•cm-3.
①计算完成上表△H=-56.85(保留2位小数).
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ•mol-1.
(4)若用KOH代替NaOH,对测定结果无(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果有填“有”或“无”)影响.
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是量筒、温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?不能(填“能”或“否”),其原因是金属易导热,热量散失导致误差大.
(3)他们记录的实验数据如下:
| 实验用品 | 溶液温度 | 中和热 | ||
| t1 | t2 | △H | ||
| ① | 50 mL0.55 mol•L-1NaOH溶液 | 20℃ | 23.3℃ | |
| 50 mL0.5 mol•L-1HCl溶液 | ||||
| ② | 50 mL0.55 mol•L-1NaOH溶液 | 20℃ | 23.5℃ | |
| 50 mL0.5 mol•L-1HCl溶液 | ||||
①计算完成上表△H=-56.85(保留2位小数).
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ•mol-1.
(4)若用KOH代替NaOH,对测定结果无(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果有填“有”或“无”)影响.
11.下列离子方程式书写正确的是( )
| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 氢氧化铝与盐酸:Al(OH)3+3H+═Al3++3H2O | |
| C. | 铁溶于氯化铁溶液:Fe+Fe3+═2Fe2+ | |
| D. | 氨气溶于醋酸:H++NH3═NH4+ |
15.常温下,100mL 0.1mol•L-1的三种盐溶液NaX、NaY、NaZ的pH分别为7、8、9,则下列比较中正确的是( )
| A. | HX、HY、HZ的酸性依次增强 | |
| B. | 溶液中的离子浓度c(X-)<c(Y-)<c(Z-) | |
| C. | 电离常数K(HY)>K(HZ),水解常数K(Y-)>K(Z-) | |
| D. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) |
 、醛基-CHO、羧基-COOH、-COOR酯基.
、醛基-CHO、羧基-COOH、-COOR酯基.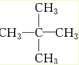 ,名称为2,2-二甲基丙烷.
,名称为2,2-二甲基丙烷.