题目内容
甲醇是一种重要的化工原料,有着重要的用途和应用前景。请回答下列问题:
(1)工业生产甲醇的常用方法是CO(g)+2H2(g) CH3OH(g) ΔH=-90.8 kJ·mol-1。
CH3OH(g) ΔH=-90.8 kJ·mol-1。
已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1;
H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1;
2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1;
CH3OH(g)===CH3OH(l) ΔH=-37.3 kJ·mol-1。
计算液体CH3OH的燃烧热为 。
(2)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH 氧化为
氧化为
NO (2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO
(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO 反应转化为两种无毒气体。写出加入甲醇后反应的离子方程式: 。
反应转化为两种无毒气体。写出加入甲醇后反应的离子方程式: 。
(3)甲醇不完全燃烧产生的CO可利用I2O5来除去,其反应为5CO(g)+I2O5(s) 5CO2(g) +I2(s)。不
5CO2(g) +I2(s)。不
同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得的CO2体积分数随着时间
t变化曲线如图所示。则:

①T2温度时,0~0.5 min的反应速率v(CO)= 。
②T1温度时,反应达到平衡,CO的转化率为 ,化学平衡常数K= (用具体数值表示)。
③下列说法正确的是 (填编号)。
A.容器内压强不变,表明反应达到平衡状态
B.容器内气体密度不变,表明反应达到平衡状态
C.单位时间内,消耗a mol CO,同时消耗2a mol CO2, 表明反应v(正)<v(逆)
D.两种温度下,c点时体系中混合气体的压强相等
E.反应5CO(g)+I2O5(s) 5CO2(g)+I2(s)为吸热反应
5CO2(g)+I2(s)为吸热反应
(4)将500 mL(标准状况)甲醇不完全燃烧产生的气体样品通过盛有足量I2O5的干燥管,170 ℃下充分反应,用水—乙醇液充分溶解产物I2,定容到100 mL。取25.00 mL,用0.0100 mol·L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00 mL,则样品气中CO的体积分数为 。(已知:气体样品中其他成分与I2O5不反应;2Na2S2O3+I2=2NaI+Na2S4O6)
 阅读快车系列答案
阅读快车系列答案

 A↑+2B↑+4C↑,测得反应后生成的混合气体对H2的相对密度为11.43,在相同条件下,X的相对分子质量是( )
A↑+2B↑+4C↑,测得反应后生成的混合气体对H2的相对密度为11.43,在相同条件下,X的相对分子质量是( ) 3C+4D反应中,表示该反应速率最快的是 ( )
3C+4D反应中,表示该反应速率最快的是 ( ) .4 g
.4 g )含有相同官能团的同分异构体有( )
)含有相同官能团的同分异构体有( ) 解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初始阶段阴极的电极反应式是________。
解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如下图。电解初始阶段阴极的电极反应式是________。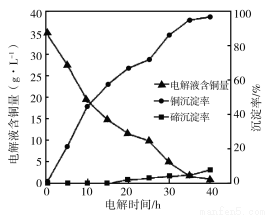
 2SO4的混合溶液分成两等份,其中一份加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c molNH3气体,则原溶液中的Al3+离子的浓度(mol/L)为( )
2SO4的混合溶液分成两等份,其中一份加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀;另一份加入足量强碱并加热可得到c molNH3气体,则原溶液中的Al3+离子的浓度(mol/L)为( ) B.
B.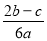 C.
C.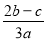 D.
D.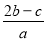
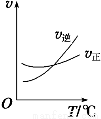
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。下列说法不正确的是
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。下列说法不正确的是