题目内容
气体A密度(相对于H2)为16.02,1体积A受热分解得2体积气体(同温、同压)
(1)求A的分子式:
(2)1体积A和足量H2O反应得4体积气体(同温、同压),请写出反应方程式.
(1)求A的分子式:
(2)1体积A和足量H2O反应得4体积气体(同温、同压),请写出反应方程式.
考点:化学方程式的有关计算
专题:计算题
分析:(1)A的分子量16.02×2.00=32.04,1体积气体分解得到2体积气体,只可能是H2,所以A中另一元素为Si,A的分子式为SiH4;
(2)1体积SiH4和足量H2O反应得4体积气体(同温、同压),只能是H2,同时得到原硅酸(或硅酸).
(2)1体积SiH4和足量H2O反应得4体积气体(同温、同压),只能是H2,同时得到原硅酸(或硅酸).
解答:
解:(1)A的分子量16.02×2.00=32.04,1体积气体分解得到2体积气体,只可能是H2.A分子中含有4个H原子,另外元素相对原子质量为32-4=28,所以A中另一元素为Si,A的分子式为SiH4,
答:A的分子式为SiH4;
(2)1体积SiH4和足量H2O反应得4体积气体(同温、同压),只能是H2,同时得到原硅酸(或硅酸),反应方程式为:SiH4 (g)+4H2O=4H2 (g)+H4SiO4或 SiH4 (g)+3H2O=4H2 (g)+H2SiO3,
答:反应方程式为:SiH4 (g)+4H2O=4H2 (g)+H4SiO4或 SiH4 (g)+3H2O=4H2 (g)+H2SiO3.
答:A的分子式为SiH4;
(2)1体积SiH4和足量H2O反应得4体积气体(同温、同压),只能是H2,同时得到原硅酸(或硅酸),反应方程式为:SiH4 (g)+4H2O=4H2 (g)+H4SiO4或 SiH4 (g)+3H2O=4H2 (g)+H2SiO3,
答:反应方程式为:SiH4 (g)+4H2O=4H2 (g)+H4SiO4或 SiH4 (g)+3H2O=4H2 (g)+H2SiO3.
点评:本题考查无机物推断、化学方程式计算等,难度中等,关键是确定A分解得到的气体为氢气.

练习册系列答案
相关题目
下列解释实际应用的原理表达式中,不正确的是( )
| A、用排饱和食盐水法收集Cl2:Cl2+H2O?H++Cl-+HClO |
| B、热的纯碱溶液碱性增强:CO32-+2H2O?H2CO3+2OH- |
| C、向Mg(OH)2悬浊液中加入FeCl3溶液:3Mg(OH)2(s)+2Fe3+═2 Fe(OH)3(s)+3Mg2+ |
| D、配制FeCl3溶液时为防止溶液浑浊加入少量稀盐酸Fe3++3H2O?Fe(OH)3+3H+ |
两种气态烃组成的混合气体0.1mol,完全燃烧得0.16mol CO2和3.6g水,下列说法正确的是( )
| A、混和气体中一定有CH4 |
| B、混和气体中一定有甲烷和乙烯 |
| C、混和气体中一定没有乙烷 |
| D、混和气体中一定有乙炔 |
标准状况下,1.12L CH4和C2H4的混合气体通入足量溴水中,溴水增重0.28克,则乙烯占混合气体的体积分数为( )
| A、20% | B、40% |
| C、60% | D、80% |
油脂皂化反应后使肥皂和甘油充分分离,这种分离方法及该方法属于( )
| A、盐析 化学变化 |
| B、萃取 物理变化 |
| C、盐析 物理变化 |
| D、蒸馏 物理变化 |
有机物M的结构简式如图,下列叙述正确的是( )


| A、1mol M与氢氧化钠溶液反应完全,消耗3molNaOH |
| B、M不能与碳酸钠溶液反应 |
| C、M既能与乙酸反应,又能与乙醇反应 |
| D、1mol M分别与Na和NaHCO3完全反应时,产生气体的物质的量之比为3:1 |

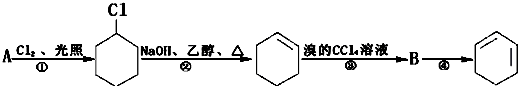
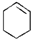 具有的性质叙述正确的是
具有的性质叙述正确的是