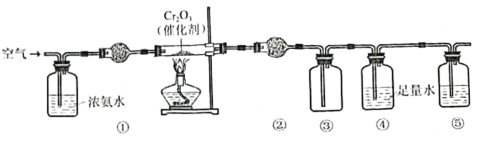
题目内容
【题目】I.标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O=O键的键焓分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1,请写出水蒸气分解的热化学方程式__________。
II.甲醇(CH3OH)广泛用作燃料电池的燃料,可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
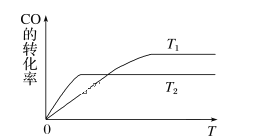
①T1____T2(填“>”“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1____(填“>”“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是______(填字母)。
a. 降低温度 b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂 d. 充入He,使体系总压强增大
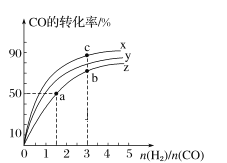
(2)在容积为1 L的恒容容器中,分别研究在300 ℃、350 ℃和370 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线x对应的温度是______℃;曲线z对应的温度下上述反应的化学平衡常数为______。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___________。
【答案】2H2O(g)=2H2(g)+O2(g) ΔH=+485 kJ·mol-1 < > cd 300 4 K1=K2<K3
【解析】
I.旧键断裂需要吸收能量,新键的生成会放出能量,△H=反应物的键能和-生成物的键能和;
II.(1)①据温度对化学平衡的影响来回答,先拐先平温度高T2>T1,CO转化率减小,说明升温平衡逆向进行,温度对化学平衡常数的影响和反应的吸放热有关,平衡逆向进行平衡常数减小;
②化学平衡正向移动可提高CO的转化率;
(2)正反应放热,则升高温度CO的转化率降低;计算出平衡时各物质的浓度,结合平衡常数的定义进行计算;平衡常数是温度的函数,正反应是放热反应,温度越高K越小。
I.旧键断裂需要吸收能量,新键的生成会放出能量,△H=反应物的键能和-生成物的键能和,△H=4×463kJ·mol-1-(2×436kJ·mol-1+495kJ·mol-1)=485kJ·mol-1,水蒸气分解的热化学方程式2H2O(g)=2H2(g)+O2(g) ΔH=+485 kJ·mol-1 ;
II.(1)①反应CO(g)+2H2(g)![]() CH3OH(g)中,反应向右进行,一氧化碳的转化率增大,温度升高,化学平衡向着吸热方向进行,根据图中的信息可以知道先拐先平温度高:T1<T2;
CH3OH(g)中,反应向右进行,一氧化碳的转化率增大,温度升高,化学平衡向着吸热方向进行,根据图中的信息可以知道先拐先平温度高:T1<T2;
温度越高CO转化率越小,说明升温平衡逆向进行,逆反应为吸热反应,所以正反应是放热反应,△H<0,对于放热反应,温度越高,平衡逆向进行化学平衡常数越小,因为图象分析可知T2>T1,所以K1>K2,
②a. 若容器容积不变,降低温度,反应CO(g)+2H2(g)![]() CH3OH(g)平衡正向移动,CO的转化率增大;
CH3OH(g)平衡正向移动,CO的转化率增大;
b. 将CH3OH(g)从体系中分离,平衡正向移动,CO转化率增大;
c. 使用合适的催化剂,平衡不移动,CO转化率不变;
d. 充入He,使体系总压强增大,但各组分的浓度不变,化学平衡不移动,CO的转化率不变;
故选cd;
(2)根据该反应为放热反应,温度越高CO的转化率越小,所以曲线x为300℃,
由图象可知当370℃时,CO的转化率为50%,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)![]() CH3OH (g)
CH3OH (g)
起始(mol·L-1) 1 1.5 0
转化(mol·L-1) 0.5 1 0.5
平衡(mol·L-1) 0.5 0.5 0.5
K=c(CH3OH)/[c(CO)c2(H2)]=0.5/[0.5×0.52]=4,
曲线上a、b是等温,温度高于c点的温度,所以K1═K2<K3。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1,测得反应的相关数据如下:
容器 | 容器类型 | 初始体积 | 初始压强/Pa | 反应物投入量/mol | 平衡时Cl2的物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
I | 恒温恒容 | 1L |
| 4 | 1 | 0 | 0 | 1 |
II | 绝热恒容 | 1L | p2 | 0 | 0 | 2 | 2 | a |
III | 恒温恒压 | 2L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105Pa,p3=4×105Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行