题目内容
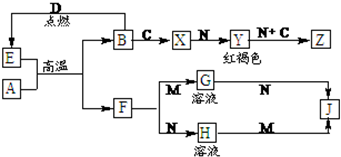
常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下.F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为198g?mol-1,且其中各元素的质量比为:钾:金属B:氧=39:28:32.
请回答下列问题:
(1)Z的化学式为: .
(2)写出检验X中阳离子的方法: .
(3)写出E和A在高温下反应的化学方程式为: .
(4)写出F和N反应的离子方程式: .
请回答下列问题:

(1)Z的化学式为:
(2)写出检验X中阳离子的方法:
(3)写出E和A在高温下反应的化学方程式为:
(4)写出F和N反应的离子方程式:
考点:无机物的推断,常见金属元素的单质及其化合物的综合应用
专题:推断题,几种重要的金属及其化合物
分析:A和B是金属单质,且二者在高温下发生置换反应,则该反应为铝热反应,所以A是Al,E是金属氧化物,F既能溶于强酸M又能溶于强碱N,F是Al2O3,B是常见金属,系列转化生成红褐色沉淀Y为Fe(OH)3,所以B是Fe,E是金属氧化物,所以D是O2,E是Fe3O4,铁和非金属单质反应生成X,X能和强碱N反应生成红褐色沉淀Fe(OH)3,氢氧化铁和碱、C反应生成Z,所以Z中含有铁元素,Z的摩尔质量为198g?mol-1,且其中各元素的质量比为:钾:铁:氧=39:28:32,钾、铁、氧的物质的量之比=
:
:
=2:1:4,所以其化学式为K2FeO4,根据元素守恒知,强碱N为KOH,氢氧化铁能被C单质氧化,且C是气体,B和C反应生成铁盐,则C是Cl2,X是FeCl3,
H为KAlO2,H和M反应生成J,J能溶于强酸和强碱,则J为Al(OH)3,结合物质的性质分析解答.
| 39 |
| 39 |
| 28 |
| 56 |
| 32 |
| 16 |
H为KAlO2,H和M反应生成J,J能溶于强酸和强碱,则J为Al(OH)3,结合物质的性质分析解答.
解答:
解:A和B是金属单质,且二者在高温下发生置换反应,则该反应为铝热反应,所以A是Al,E是金属氧化物,F既能溶于强酸M又能溶于强碱N,F是Al2O3,B是常见金属,系列转化生成红褐色沉淀Y为Fe(OH)3,所以B是Fe,E是金属氧化物,所以D是O2,E是Fe3O4,铁和非金属单质反应生成X,X能和强碱N反应生成红褐色沉淀Fe(OH)3,氢氧化铁和碱、C反应生成Z,所以Z中含有铁元素,Z的摩尔质量为198g?mol-1,且其中各元素的质量比为:钾:铁:氧=39:28:32,钾、铁、氧的物质的量之比=
:
:
=2:1:4,所以其化学式为K2FeO4,根据元素守恒知,强碱N为KOH,氢氧化铁能被C单质氧化,且C是气体,B和C反应生成铁盐,则C是Cl2,X是FeCl3,H为KAlO2,H和M反应生成J,J能溶于强酸和强碱,则J为Al(OH)3;
(1)通过以上分析知,Z是高铁酸钾,其化学式为K2FeO4,故答案为:K2FeO4;
(2)X是氯化铁,铁离子和硫氰根离子反应生成血红色溶液,所以可以用硫氰化钾溶液检验铁离子,其操作方法是:取试样少许,滴加3~4滴KSCN溶液,呈血红色,
故答案为:取试样少许,滴加3~4滴KSCN溶液,呈血红色;
(3)高温下,四氧化三铁和铝发生置换反应生成氧化铝和铁,反应方程式为8Al+3Fe3O4
4Al2O3+9Fe,
故答案为:8Al+3Fe3O4
4Al2O3+9Fe;
(4)F是氧化铝,N是氢氧化钾,氧化铝和氢氧化钾溶液反应生成偏铝酸钾和水,离子反应方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
| 39 |
| 39 |
| 28 |
| 56 |
| 32 |
| 16 |
(1)通过以上分析知,Z是高铁酸钾,其化学式为K2FeO4,故答案为:K2FeO4;
(2)X是氯化铁,铁离子和硫氰根离子反应生成血红色溶液,所以可以用硫氰化钾溶液检验铁离子,其操作方法是:取试样少许,滴加3~4滴KSCN溶液,呈血红色,
故答案为:取试样少许,滴加3~4滴KSCN溶液,呈血红色;
(3)高温下,四氧化三铁和铝发生置换反应生成氧化铝和铁,反应方程式为8Al+3Fe3O4
| ||
故答案为:8Al+3Fe3O4
| ||
(4)F是氧化铝,N是氢氧化钾,氧化铝和氢氧化钾溶液反应生成偏铝酸钾和水,离子反应方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评:本题考查了铝、铁及其化合物之间的转化,根据铝热反应为突破口结合Z的相对分子质量推断物质,结合物质之间反应的特殊现象来分析解答,难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
| C、向饱和ZnS溶液中加入Na2S有沉淀析出,但KSP(ZnS)不变 |
| D、50℃时,pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
已知KClO3+6HCl=KCl+3C12↑+3H2O,若用K35Cl03与H37Cl作用,则下列说法中正确的是( )
| A、该反应中转移电子数为6 |
| B、Cl2中只含37Cl |
| C、Cl2中既有35Cl 又含37C1 |
| D、生成的氯气相对分子质量约为73.3g/mol |
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、8.4g NaHCO3固体中含有0.1NA个CO32- |
| B、1 mol CH3Cl中所含的共价键数为4NA |
| C、常温常压下,22.4L的NO2和CO2混合气体含有2NA个O原子 |
| D、5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |