题目内容
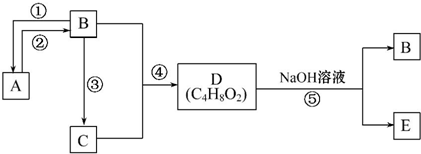
7.已知A 是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图1所示.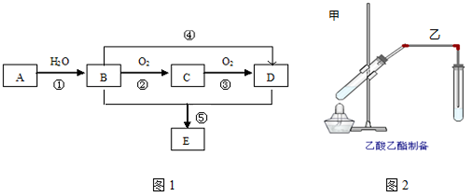
请回答下列问题:
(1)B分子中官能团的名称为醇羟基.
(2)B通过两次氧化可得到D,也可通过反应④直接氧化为D,则需要加入的氧化试剂为酸性高锰酸钾溶液或酸性重铬酸钾溶液(任填一种).
(3)写出下列反应的化学方程式:
①CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH;反应类型:加成反应.
②
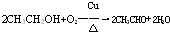 .
.(4)反应⑤可按下进行:
【实验步骤】
如图2在试管甲中先加入2mL 95%的B,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2mL D,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和碳酸钠溶液,按图2连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到乙试管中有明显现象时停止实验.试回答:
【实验结果】
a.试管乙中观察到的现象是液面上有透明的不溶于水的油状液体产生,并可闻到香味.
b.试管甲中反应的化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,反应类型为酯化反应(或取代反应).
【问题探究】
本实验反应开始时用小火加热的原因是防止乙醇和乙酸挥发.
(查阅资料可知:乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
分析 A 是一种分子量为28的气态烃,则A为CH2=CH2,以A为主要原料合成一种具有果香味的物质E,E为酯,B能连续被氧化,则B为CH3CH2OH、C为CH3CHO、D为CH3COOH、E为CH3COOCH2CH3,
(1)B中官能团是醇羟基;
(2)乙醇能被强氧化剂氧化生成乙酸;
(3)①为乙烯和水的加成反应;
②为乙醇的催化氧化反应;
(4)【实验结果】
a.甲中乙酸和乙醇在浓硫酸作催化剂加热条件下反应生成乙酸乙酯,乙酸乙酯不易溶于水且为有香味的油状液体;
b.乙酸和乙醇的反应为酯化反应,也是取代反应;
【问题探究】
乙醇和乙醇都具有挥发性,温度高时能挥发.
解答 解:A 是一种分子量为28的气态烃,则A为CH2=CH2,以A为主要原料合成一种具有果香味的物质E,E为酯,B能连续被氧化,则B为CH3CH2OH、C为CH3CHO、D为CH3COOH、E为CH3COOCH2CH3,
(1)B为CH3CH2OH,B中官能团是醇羟基,故答案为:醇羟基;
(2)乙醇能被强氧化剂氧化生成乙酸,如高锰酸钾或重铬酸钾都能氧化乙醇生成乙酸,故答案为:酸性高锰酸钾溶液或酸性重铬酸钾溶液;
(3)①为乙烯和水的加成反应,反应方程式为,为加成反应CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH,故答案为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH;加成反应;
②为乙醇的催化氧化反应,反应方程式为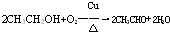 ,故答案为:
,故答案为: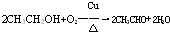 ;
;
(4)【实验结果】
a.甲中乙酸和乙醇在浓硫酸作催化剂加热条件下反应生成乙酸乙酯,乙酸乙酯不易溶于水且为有香味的油状液体,所以乙中现象是液面上有透明的不溶于水的油状液体产生,并可闻到香味,
故答案为:液面上有透明的不溶于水的油状液体产生,并可闻到香味;
b.乙酸和乙醇的反应为酯化反应,也是取代反应,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,酯化反应(或取代反应)
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应(或取代反应);
【问题探究】
乙醇和乙醇都具有挥发性,温度高时能挥发,为防止乙醇和乙酸挥发,需要小火加热,故答案为:防止乙醇和乙酸挥发.
点评 本题考查有机合成及物质制备,为高频考点,侧重考查学生分析推断及实验制备能力,明确物质结构和性质、制备原理及实验设计是解本题关键,题目难度不大.

| A. | ⅡA | B. | ⅡB | C. | ⅤⅡ | D. | ⅠB |
| A. | NaCl | B. | NaBr | C. | KI | D. | I2 |
| A. | 硅单质溶于入氢氧化钠溶液中:Si+2OH-+H2O═SiO3-+2H2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 在碳酸氢镁溶液中加入过量氢氧化钠溶液:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| D. | 向NaAlO2溶液中加入过量稀盐酸:AlO2-+4H+═Al3++2H2O |
 (1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol
(1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol①下列描述中能说明上述反应已达平衡的是bd.
a.υ(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2半分钟后达到平衡,测得容器中含SO30.18mol,则υ(O2)=0.036mol•L-1•min-1;若继续通入0.4molSO2和0.2molO2则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.54mol<n(SO3)<0.6mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)],反应的化学方程式为2NH3(g)+CO2(g)?CO(NH2)(1)+H2O(l),该反应的平衡常数和温度关系如下:
| T/°C | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{{n(N{H_3})}}{{n(C{O_2})}}=x$,下图是氨碳比(x)与CO2平衡转化率(a)的关系.a随着x增大而增大的原因是NH3的量增大,平衡正向移动,则增大CO2的转化率.
(3)图中的B点处,NH3的平衡转化率为32%.
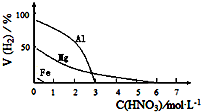 HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:(1)浓度不同HNO3氧化性不同,试举一例说明浓硝酸能与碳反应,而稀硝酸不能.
(2)HNO3能氧化多种金属.金属活动顺序中,Ag以前的金属都能与HNO3反应,但常温下Fe、Al(填元素符号)在浓HNO3中能钝化.
(3)盐酸对HNO3氧化性有影响.浓硝酸与浓盐酸按1:3体积比混合所得混合液称王水,具有强氧化性.金溶于王水产生遇空气变色的气体,金转化为易溶性强酸H[AuCl4].请写出其离子方程式:Au+4H++NO3-+4Cl-=NO↑+AuCl4-+2H2O.
(4)与金属反应的过程中,HNO3能被还原成多种含氮产物,如:NO2、HNO2、NO、N2O、N2、NH2OH、NH4+(或硝酸铵NH4NO3).
(5)HNO3是一种强酸,与活泼金属反应时,HNO3的还原产物中可能存在H2,某兴趣小组设计实验,探究金属与稀HNO3反应制取H2的影响因素,其结果如图所示.
该兴趣小组设计以下实验,探究金属与HNO3反应产生H2的影响因素可供选择的试剂:Fe粉、Mg粉,HNO3(0.1mol•L-1、2.0mol•L-1)
| 影响因素 | 实验步骤 | 实验结论 |
| 金属的种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入2mol•L-1 HNO3溶液50mL,反应结束后,用气体分析仪测定气体中H2的体积分数 | 在该浓度的稀HNO3中,Mg能反应, Fe粉不反应, |
| 硝酸的浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入0.1mol•L-1HNO3、2.0mol•L-1HNO3,反应结束后,用气体分析仪测定气体中H2的体积分数 | 硝酸浓度越稀,产生氢气越多. |
 卤族元素中Cl、Br、I在海洋中含量丰富,F在自然界中常以CaF2的形式存在.
卤族元素中Cl、Br、I在海洋中含量丰富,F在自然界中常以CaF2的形式存在. ,1molNH4NO3中含有σ键数目为7mol(或7×6.02×1023).其中阴、阳离子中心原子杂化类型分别为:sp2、sp3.
,1molNH4NO3中含有σ键数目为7mol(或7×6.02×1023).其中阴、阳离子中心原子杂化类型分别为:sp2、sp3.
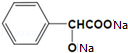 +H2↑.
+H2↑.