题目内容
8.(1)含0.4mol A13+的Al2(SO4)3中所含的SO42-的物质的量是0.6mol;(2)已知16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为106g/mol;
(3)如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(设NA为阿伏加德罗常数)$\frac{22.4bc}{a{N}_{A}}$L.
(4)在标准状况下,44.8L的NH3气体质量为34g,
其中含6NA个氢原子,其中含2 molN,将其溶于水配成200mL的溶液,其物质的量浓度为10 mol/L.
分析 (1)根据化学式可知n(Al3+):n(SO42-)=2:3,据此计算SO42-的物质的量;
(2)先根据质量守恒定律来计算生成的C物质的质量,再利用M=$\frac{m}{n}$计算其摩尔质量;
(3)同种气体,其质量与分子数成正比,计算cg气体含有分子数目,然后根据n=$\frac{N}{{N}_{A}}$,V=n×Vm来计算.
(4)根据n=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$结合物质的构成计算,然后根据c=$\frac{n}{V}$计算所得溶液的浓度.
解答 解:(1)Al2(SO4)3中n(Al3+):n(SO42-)=2:3,故含0.4mol Al3+的Al2(SO4)3中所含SO42-的物质的量是0.4mol×$\frac{3}{2}$=0.6mol,
故答案为:0.6mol;
(2)16gA物质和20gB恰好完全反应生成0.04molC和31.76gD,由质量守恒定律可知,则C的质量为:16g+20g-31.76g=4.24g,C的摩尔质量为:$\frac{4.24g}{0.04mol}$=106g/mol,
故答案为:106g/mol;
(3)a克某气体中含有的分子数为b,则c克气体含有的分子数为$\frac{cb}{a}$,c克该气体的物质的量为:$\frac{\frac{bc}{a}}{{N}_{A}mo{l}^{-1}}$=$\frac{bc}{a{N}_{A}}$mol,在标准状况下Vm=22.4L/mol,则cg该气体的体积为:$\frac{bc}{a{N}_{A}}$mol×22.4L/mol=$\frac{22.4bc}{a{N}_{A}}$L,
故答案为:$\frac{22.4bc}{a{N}_{A}}$L;
(4)n(NH3)=$\frac{44.8L}{22.4L/mol}$=2mol,m(NH3)=2mol×17g/mol=34g;N(H)=3N(NH3)=2mol×3×NA/mol=6NA;n(N)=n(NH3)=2mol;
将2mol安全溶于水配成200mL的溶液,其物质的量浓度为:$\frac{2mol}{0.2L}$=10mol/L,
故答案为:34;6NA;2;10.
点评 本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力的考查,注意把握相关计算公式的运用,难度不大.

| A. | 某溶液$\stackrel{+AgNO_{3}溶液}{→}$生成白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液$\stackrel{+NaOH溶液}{→}$生成蓝色沉淀,说明原溶液中有Cu2+ | |
| C. | 某溶液$\stackrel{+BaCl_{2}溶液}{→}$生成白色沉淀,说明原溶液中有SO42- | |
| D. | 某溶液$\stackrel{+KOH溶液}{→}$生成红褐色沉淀,说明原溶液中有Mg2+ |
| A. | 0.1mol/LNa2CO3溶液:c(Na+)=2c(H2CO3)+2 c(HCO3-)+c(CO32?) | |
| B. | 能使酚酞溶液呈红色的溶液:Na+、Ba2+、I-、NO3-可以大量共存 | |
| C. | 任何条件下,pH=1的硫酸溶液中:c(H+)=0.1mol/L | |
| D. | 将0.2 mol•L-1的HCN溶液和0.1 mol•L-1的NaOH溶液等体积混合,溶液显碱性,则c(HCN)=c(CN-)=c(Na+) |
| A. | MgCl2 的摩尔质量为95 g | |
| B. | 常温常压下,1 mol CO2的质量是44 g | |
| C. | 标准状况下,1 mol H2O所占的体积约为22.4 L | |
| D. | 100 mL 1mol/L的稀硫酸中含有H+ 的数目约为6.02×1022 |
| A. | 制造炊具 | B. | 制儿童玩具油漆 | C. | 制牙膏皮 | D. | 炼铝厂制造铝锭 |
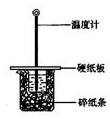 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,求得的中和热数值偏小(填“偏大、偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等、不相等”),简述理由中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会偏小(填“偏大”、“偏小”、“无影响”,下同) 若用KOH代替NaOH,测定结果会无影响
(5)他们记录的实验数据如下:
| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.5℃ | |
①计算完成表.
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.8kJ/mol.
| 实验目的 | 试剂 | 试管中的物质 |  | |
| A | 苯环对甲基的影响 | 酸性KMnO4溶液 | ①苯②甲苯 | |
| B | 比较Br-、Fe2+和I-的还原性 | 氯水 | ①FeBr2溶液②FeI2溶液 | |
| C | 苯分子中没有碳碳双键 | Br2的CCl4溶液 | ①苯②己烯 | |
| D | 探究接触面积对反应速率的影响 | VmL、cmol/L的盐酸 | ①ag大理石块②ag大理石粉 |
| A. | A | B. | B | C. | C | D. | D |
 某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.
某化学小组设计如图装置,探究铜和一定量的浓HNO3是否反应是否有NO生成.已知:A试管内空气体积为50mL(标准状况),B广口瓶盛80mL水,硝酸不溶于煤油.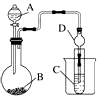 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.