题目内容
6.某铁的氧化物(FexO)3.48g溶于足量盐酸中,向所得溶液中通入0.5325g Cl2,恰好将Fe2+完全氧化.则x值为( )| A. | 0.67 | B. | 0.75 | C. | 0.80 | D. | 1.00 |
分析 根据电子守恒可知,FexO被氧化为Fe3+转移的电子数和Cl2转移的电子数相等,以此解答该题.
解答 解:FexO中Fe的平均化合价为+$\frac{2}{x}$,被氧化为Fe3+,根据电子守恒可知,转移的电子数和Cl2转移的电子数相等.0.5325g Cl2转移电子数为$\frac{0.5325g}{71g/mol}$×2=0.015mol.则有:$\frac{3.48g}{(66x+16)g/mol}$×(3-$\frac{2}{x}$)×x=0.015mol,解得x=0.75,
故选B.
点评 本题考查氧化还原反应计算,注意氧化还原反应计算中电子转移守恒运用,本题中注意平均化合价的应用,侧重考查学生的分析计算能力.

练习册系列答案
相关题目
16.下列实验方法或实验叙述正确的是( )
| A. | 将pH试纸放入某溶液中,显色后和标准比色卡对比以测定该溶液的pH | |
| B. | 过滤操作时,漏斗下部的尖嘴要紧靠烧杯的内壁 | |
| C. | 某溶液加氯化钡溶液有白色沉淀生成,说明原溶液中一定有SO42- | |
| D. | 向溶液中先滴加氯水,再滴加KSCN溶液,溶液呈红色,说明原溶液中一定含Fe2+ |
17.下列设计的实验方案不能达到实验目的是( )
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中滴加过量的6mol•L-1氨水 | |
| B. | 提纯含有少量苯酚的苯:向含有少量苯酚的苯中加入适量浓溴水,过滤 | |
| C. | 检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
14.下列物质与危险化学品标志的对应关系错误的是( )
| A. |  氢气 | B. |  过氧化钠 | C. |  浓硫酸 | D. |  醋酸 |
1.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 证明溶液中一定含有SO32- | 将该溶液与稀盐酸反应产生的气体通入澄清石灰水,有白色沉淀生成 |
| B | 证明氯气中混有氯化氢气体 | 将该混合气体通入AgNO3溶液中,有白色沉淀生成 |
| C | 证明某固体中有Na+,无K+ | 灼烧该固体,火焰呈黄色 |
| D | 证明Br-还原性强于Cl- | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色 |
| A. | A | B. | B | C. | C | D. | D |
11.下列溶液中的离子关系正确的是( )
| A. | 相同温度下,0.2mol/L的醋酸溶液与0.lmol/L的醋酸溶液中c(H+)之比大于2:1 | |
| B. | pH=3的醋酸和pH=3的FeCl3溶液中,由水电离出的c (H+)相等 | |
| C. | 0.lmol•L-1NaHSO4溶液中:c(H+)=c (SO42-)+c (OH-) | |
| D. | 浓度均为0.lmol•L-1的CH3COOH、CH3COONa 混合溶液pH=4,则:c(CH3COO-)-c(CH3COOH)=10-4-10-10mol/L |
2.NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4LH2O含有分子数为1NA | |
| B. | 常温常压下,224LH2和O2的混合气体所含分子数为NA | |
| C. | 通常状况下,1molCl2与足量Na反应转移电子数为NA | |
| D. | 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA |
20.玉米芯与稀硫酸在加热加压下反应,可以制得糠醛(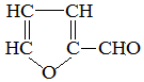 ),糠醛是重要的化工原料,用途广泛.关于糠醛的说法,不正确的是( )
),糠醛是重要的化工原料,用途广泛.关于糠醛的说法,不正确的是( )
 ),糠醛是重要的化工原料,用途广泛.关于糠醛的说法,不正确的是( )
),糠醛是重要的化工原料,用途广泛.关于糠醛的说法,不正确的是( )| A. | 其核磁共振氢谱有3种不同类型的吸收峰 | |
| B. | 1 mol糠醛可与3 mol H2 发生加成反应 | |
| C. | 可与新制的Cu(OH)2浊液在加热时反应生成红色沉淀 | |
| D. | 与苯酚在一定条件下反应得到结构简式为 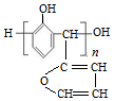 的产物 的产物 |

 .
. ;由E合成G的化学方程式为
;由E合成G的化学方程式为 .
.