题目内容
19.硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7•10H2O)时的废渣,其主要成分是MgO,还含有CaO、Fe2O3、FeO、MnO、B2O3、SiO2等杂质.以硼镁泥为原料制取的七水硫酸镁在印染、造纸和医药等工业上都有广泛的应用.硼镁泥制取七水硫酸镁的工艺流程如图: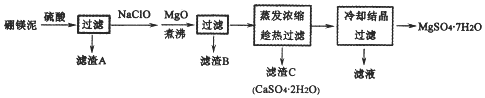
回答下列问题:
(1)Na2B4O7•10H2O中B的化合价为+3.
(2)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,写出生成黑色固体的离子方程式ClO-+Mn2++H2O=MnO2+Cl-+2H+,该反应中,氧化剂与还原剂的物质的量之比为1:1,还原产物是Cl-.
(3)加入MgO的目的是调节溶液的pH值,使Fe3+转化为氢氧化铁沉淀除去该过程除了加入MgO外,还能选择加入下列物质中的①③(填编号)
①碳酸镁 ②氨水 ③氢氧化镁 ④氢氧化钠
(4)因B2O3溶于硫酸,所以此法制备的七水硫酸镁含有少量硼酸(H3BO3),硼酸与NaOH溶液反应可制得硼砂晶体,写出生成硼砂晶体的化学方程式4H3BO3+2NaOH+3H2O=Na2B4O7•10H2O .
(5)Na2B4O7•10H2O失去全部结晶水后的硼砂与金属钠、氢气及石英砂一起反应可制备有机化学中的“万能还原剂--NaBH4”(该过程B的化合价不变).“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力.NaBH4的有效氢含量为0.21 (计算结果保留两位小数).
分析 硼镁泥主要成份是MgO,还有CaO、Al2O3、Fe2O3、FeO、MnO、B2O3、SiO2等杂质,加入硫酸,MgO、CaO、Al2O3、Fe2O3、FeO、MnO、B2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,加MgO调节pH,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤,滤渣B含有Fe(OH)3、Al(OH)3、MnO2,蒸发浓缩滤液,趁热过滤,滤渣C为硫酸钙晶体,滤液中含镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体,
(1)化学式中元素化合价代数和为0计算;
(2)渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体为MnO2,加入的NaClO可与Mn2+反应生成MnO2,结合电子守恒和原子守恒配平书写离子方程式,元素化合价升高的做还原剂,元素化合价降低的做氧化剂,氧化剂被还原得到还原产物;
(3)加入MgO的目的是调节溶液PH沉淀铁离子,加入的试剂和酸反应但不能引入新的杂质;
(4)H3BO3与NaOH溶液反应生成Na2B4O7•lOH2O;
(5)每克含氢还原剂的还原能力相当于多少克H2的还原能力,则NaBH4变化为H+,电子转移和氢气变化为氢离子电子转移相同,据此计算;
解答 解:硼镁泥主要成份是MgO,还有CaO、Al2O3、Fe2O3、FeO、MnO、B2O3、SiO2等杂质,加入硫酸,MgO、CaO、Al2O3、Fe2O3、FeO、MnO、B2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,加MgO调节pH,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤,滤渣B含有Fe(OH)3、Al(OH)3、MnO2,蒸发浓缩滤液,趁热过滤,滤渣C为硫酸钙晶体,滤液中含镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体,
(1)Na2B4O7•10H2O中,钠的化合价+1价,氧元素化合价-2价,元素化合价代数和为0计算得到B的化合价为:2×(+1)+4x+(-2)×7=0,x=+3,
故答案为:+3;
(2)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,生成黑色固体的离子方程式为:ClO-+Mn2++H2O=MnO2+Cl-+2H+,该反应中氯元素化合价+1价变化为-1价,次氯酸钠做氧化剂,锰离子做还原剂,氧化剂与还原剂的物质的量之比为1:1,还原产物为Cl-,
故答案为:ClO-+Mn2++H2O=MnO2+Cl-+2H+;1:1;Cl-;
(3)加入MgO的目的是调节溶液的pH值,使Fe3+转化为氢氧化铁沉淀除去,该过程除了加入MgO外,还能选择加入物质能和酸反应调节溶液PH,且不能引入新的杂质,选择①碳酸镁,③氢氧化镁,②氨水会引入铵根离子,④氢氧化钠加入会引入钠离子,故选①③,
故答案为:调节溶液的pH值,使Fe3+转化为氢氧化铁沉淀除去;①③;
(4)H3BO3与NaOH溶液反应生成Na2B4O7•lOH2O,其反应方程式为:4H3BO3+2NaOH+3H2O=Na2B4O7•lOH2O,
故答案为:4H3BO3+2NaOH+3H2O=Na2B4O7•10H2O;
(5)每克含氢还原剂的还原能力相当于多少克H2的还原能力,则NaBH4变化为H+,电子转移8e-,电子转移和氢气变化为氢离子电子转移相同,设相当于氢气质量为x,计算为:
$\frac{1\\;g}{37.8g/mol}$×8=$\frac{\\;x}{2}$×2
x=0.21g
故答案为:0.21;
点评 本题考查物质制备工艺流程,涉及物质的分离与提纯、对原理与条件控制分析、盐类水解等,关键是对工艺流程理解,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.,题目难度中等.

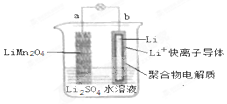 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )| A. | a 为电池的正极 | |
| B. | 电池充电反应为 LiMn2O4=Li1-xMn2O4+xLi | |
| C. | 放电时,a 极锂的化合价发生变化 | |
| D. | 放电时,溶液中 Li+从 b 向 a 迁移 |
(1)配制50mL 1.0mol•L-1的FeCl3溶液,测其pH约为0.7,即c(H+)=0.2mol•L-1.
①用化学用语解释FeCl3溶液呈酸性的原因:Fe3++3H2O?Fe(OH)3+3H+.
②下列实验方案中,能使FeCl3溶液pH升高的是acd(填字母序号).
a.加水稀释 b.加入FeCl3固体 c.滴加浓KSCN溶液 d.加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应.实验操作及现象如表:
| 操作 | 现象 |
| 向反应瓶中加入6.5g锌粉,然后加入50mL 1.0mol•L-1的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:溶液温度升高,反应过程中出现H2使溶液中c(H+)降低,都会促进Fe3++3H2O?Fe(OH)3+3H+正向移动,出现红褐色Fe(OH)3沉淀.
②用离子方程式解释反应后溶液为浅绿色的原因:2Fe3++Zn═2Fe2++Zn2+.
③分离出黑色固体,经下列实验证实了其中含有的主要物质.
i.黑色固体可以被磁铁吸引;
ii.向黑色固体中加入足量的NaOH溶液,产生气泡;
iii.将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv.向iii反应后的溶液中滴加KSCN溶液,无变化.
a.黑色固体中一定含有的物质是Fe和Zn.
b.小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是iii中,若存在Fe3O4,稀盐酸与Fe3O4反应产生的Fe3+可与Fe继续反应生成Fe2+,导致在iv中检测不到Fe3+,与没有Fe3O4得到的iv中现象相同.
(3)为进一步探究上述1.0mol•L-1FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
| 操作 | 现象 |
| 将5mL 1.0mol•L-1的FeCl3溶液与0.65g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
| 将5 mL 0.2 mol•L-1(或pH=0.7)的盐酸与0.65g锌粉混合 | 溶液中立即产生大量气泡 |
①酸 ②能导电 ③胶体 ④混合物 ⑤化合物 ⑥溶液 ⑦电解质.
| A. | ①②④⑥⑦ | B. | ①②⑤⑦ | C. | ②④⑥ | D. | ②④⑥⑦ |
| A. | 9种 | B. | 8种 | C. | 7种 | D. | 6种 |
 已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数 |
| Y | 原子核外的L层有3个未成对电子 |
| Z | 地壳中含量最多的元素 |
| Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | N能层上只有一个电子,K、L、M层均排满电子 |
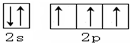
(1)写出元素Y的原子核外价电子排布图:
 .X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
.X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)N>O>C.
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)H2O,原因是水分子间可以形成氢键,使沸点升高.
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:C≡O.
(5)R的一种配合物的化学式为RCl3•6H2O.已知0.01mol RCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2OD.[R(H2O)3Cl3]•3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,继续滴加氨水至过量,沉淀溶解,
得到天蓝色溶液,写反应的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
(7)元素E的单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
若已知该元素的原子半径为d cm,相对原子质量为M,NA代表阿伏加德罗常数,则该晶体的密度为$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g•cm-3(用字母表示).
| A. | 沉淀X的成分是SiO2 | |
| B. | 将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3 | |
| C. | 在溶液Y中加入过量的NaOH溶液,过滤得到沉淀是Fe(OH)3 | |
| D. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+ |
| 选项 | 分类标准 | 分类结果 |
| A | 根据化学反应中有无单质参加或生成 | 氧化还原反应和非氧化还原反应 |
| B | 根据化学反应中有无离子参加或生成 | 离子反应和非离子反应 |
| C | 根据混合物中分散质粒子直径的大小 | 胶体、溶液和浊液 |
| D | 根据无机化合物的组成和性质特点 | 酸、碱、盐、氧化物等 |
| A. | A | B. | B | C. | C | D. | D |
| 有机物 | 试剂 | 现象 |
| (1)甲苯 | a.碘水 | A.出现光亮的银镜 |
| (2)乙醛 | b.高锰酸钾酸性溶液 | B.呈紫色 |
| (3)苯酚 | c.浓硝酸 | C.呈蓝色 |
| (4)淀粉 | d.新制银氨溶液 | D.呈黄色 |
| (5)蛋白质 | e.三氯化铁溶液 | E.紫色褪去 |