题目内容
下列离子方程式书写正确的是( )
| A、常温下,氯气通入氢氧化钠溶液中反应:Cl2+2OH-=Cl-+ClO-+H2O |
| B、硫酸和氯化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| C、铁跟稀盐酸反应:Fe+2H+=H2↑+Fe3+ |
| D、碳酸钙和醋酸反应:CO32-+2H+=CO2↑+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.常温下,氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水;
B.硫酸和氯化钡溶液反应生成硫酸钡沉淀和盐酸;
C.不符合反应的客观事实;
D.碳酸钙是沉淀、醋酸是弱电解质,都应保留化学式.
B.硫酸和氯化钡溶液反应生成硫酸钡沉淀和盐酸;
C.不符合反应的客观事实;
D.碳酸钙是沉淀、醋酸是弱电解质,都应保留化学式.
解答:
解:A.常温下,氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故A正确;
B.硫酸和氯化钡溶液反应的离子方程式:Ba2++SO42-=BaSO4↓,故B正确;
C.铁跟稀盐酸反应生成氯化亚铁和氢气,离子方程式为:Fe+2H+=H2↑+Fe2+,故C错误;
D.碳酸钙和醋酸反应的离子方程式:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑,故D错误;
故选:AB.
B.硫酸和氯化钡溶液反应的离子方程式:Ba2++SO42-=BaSO4↓,故B正确;
C.铁跟稀盐酸反应生成氯化亚铁和氢气,离子方程式为:Fe+2H+=H2↑+Fe2+,故C错误;
D.碳酸钙和醋酸反应的离子方程式:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑,故D错误;
故选:AB.
点评:离子方程式的书写以及正误判断是高考必考内容,把握离子方程式书写的方法和原则是解题的关键,注意化学式的拆分,沉淀、气体、单质、氧化物、弱电解质保留化学式.

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
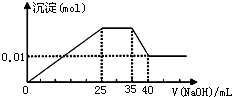 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.根据上述实验,以下推测不正确的是( )
| A、原溶液一定不存在H+、Cu2+、CO32- |
| B、不能确定原溶液是否含有K+、NO3- |
| C、实验所加的NaOH的浓度为2mol?L-1 |
| D、原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2 |
下列物质分类正确的是( )
| A、SO2、CO均为酸性氧化物 |
| B、硅酸、氯化铁溶液均为胶体 |
| C、烧碱、盐酸均为电解质 |
| D、水玻璃、氨水均为混合物 |
下列物质中既含有非极性键,又含有离子键的是( )
| A、MgBr2 |
| B、H2O2 |
| C、Na2O2 |
| D、NH4Cl |
新能源的开发利用是人类社会可持续发展的重要课题.下列属于新能源的是( )
| A、氢气 | B、煤炭 | C、天然气 | D、石油 |
下列表示对应化学反应的离子方程式正确的是( )
| A、用NaClO除去水体中CO(NH2)2产生CO2和N2,3ClO-+CO(NH2)2═3Cl-+CO2↑+N2↑+2H2O |
| B、过氧化氢能使酸性KMnO4溶液褪色:3H2O2+2MnO4-+6H+═2Mn2++4O2↑+6H2O |
| C、用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O |
| D、向Ba(OH)2溶液中逐滴加入溶液恰好沉淀完全:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
图示为一种天然产物,具有一定的除草功效.下列有关该化合物的说法错误的是( )
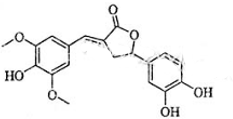

| A、分子含有三种含氧官能团 |
| B、1mol该化合物最多能与6mol NaOH反应 |
| C、既可以发生取代反应,又能够发生加成反应 |
| D、既能与FeCl3发生显色反应,也能与NaHCO3反应放出CO2 |
下列说法正确的是( )
| A、将等体积、等pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH变化大 |
| B、金属钾、钠和白磷等暴露在空气中易燃烧,所以金属钾、钠和白磷应保存在煤油中 |
| C、向滴有酚酞的Na2CO3溶液中逐滴加入Ba(NO3)2,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 |
| D、在制备硝酸钾晶体的实验中,趁热过滤时,承接滤液的小烧杯中先加2mL的水,以防过滤时硝酸钾晶体过早析出 |