题目内容
12.某大型精炼铜厂,在电解铜的阳极泥中含有 3-14% Se 元素,(Se和S同主族化学性质相似)以Se单质、Cu2Se存在,还含有稀有金属及贵金属.从阳极泥中提取Se 的流程如图: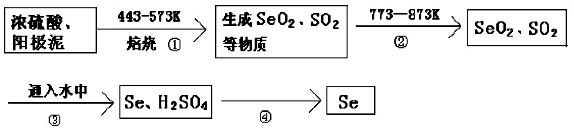
已知:SeO2在773K时为气态
(1)流程②的作用使SO2、SeO2挥发出来工业提取 Se 的流程中,可循环利用的物质是硫酸
(2)H2SeO3与SO2的离子反应方程式为H2SeO3+2SO2+H2O═Se+2SO42-+4H+.
(3)上述工业提取 Se 的流程中,SeO2、H2SO4 (浓)、SO2 的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>SO2
(4)单质硒可能成为环境污染物,可通过与浓HNO3反应生成SeO2来回收Se,Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式:Se+2HNO3(浓)=H2O+SeO2+NO↑+NO2↑ 如不对该反应还原产物的比例作限制,该反应可能出现多组配平系数(填“可能”或“不可能”)
分析 在电解铜的阳极泥中含有 3-14% Se元素,由提纯流程可知,焙烧时S、Se反应转化为SO2、SeO2,二者性质相似,均为分子晶体,加热至773K时为气态,流程②的目的是使SO2、SeO2挥发出来,再加水发生H2SeO3+2SO2+H2O═Se+2SO42-+4H+,Se不溶于水,则流程④为过滤操作,过滤可得到Se,以此来(1)、(2)、(3);
(4)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3,HNO3还原为NO与NO2,利用电子守恒和限定条件(生成NO与NO2的物质的量之比为1:1,即二者计量系数比为1:1)可得方程式,结合两种还原产物分析.
解答 解:(1)由上述分析可知,流程②的目 的是使SO2、SeO2挥发出来,由反应可知,硫酸在①中消耗,在③中生成,则硫酸可循环利用,
故答案为:使SO2、SeO2挥发出来; 硫酸;
(2)H2SeO3与SO2的离子反应方程式为H2SeO3+2SO2+H2O═Se+2SO42-+4H+,
故答案为:H2SeO3+2SO2+H2O═Se+2SO42-+4H+;
(3)由Se+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SeO2↑+2SO2↑+2H2O、H2SeO3+2SO2+H2O═Se+2SO42-+4H+可知,氧化剂的氧化性大于氧化产物的氧化性,则氧化性为H2SO4(浓)>SeO2>SO2,故答案为:H2SO4(浓)>SeO2>SO2;
(4)利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3,HNO3还原为NO与NO2,生成NO与NO2的物质的量之比为1:1,即二者计量系数比为1:1,令二者系数为1,根据电子转移守恒可知,Se的系数为$\frac{1×3+1×1}{4}$=1,故反应方程式为Se+2HNO3(浓)=H2O+SeO2+NO↑+NO2↑,如不对该反应还原产物的比例作限制,该反应可能出现多组配平系数,是因该反应有两种还原产物,两者的比例和还原剂的用量都可以发生改变;
故答案为:Se+2HNO3(浓)=H2O+SeO2+NO↑+NO2↑;可能.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程及发生的反应、混合物分离方法等为解答的关键,侧重分析、计算能力的考查,(4)为解答的难点,题目难度中等.

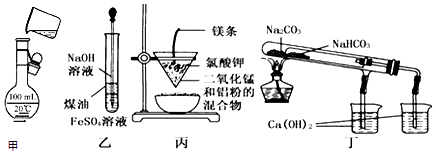
| A. | 用甲图所示装置将溶液定容到100 mL | |
| B. | 用乙图装置制备Fe(OH)2 | |
| C. | 用丙图装置可制得金属锰 | |
| D. | 用丁图装置验证NaHCO3和Na2CO3的热稳定性 |
| A. | CO2 | B. | Cl2 | C. | NH3 | D. | H2 |
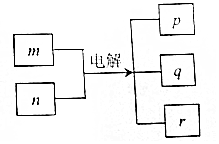 短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13,工业上制备r和q的反应如图所示,下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、n、r是由这些元素组成的化合物,p、q分别是元素W、Z的气体单质.r溶液是实验室中常见试剂,常温下0.1mol•L-1r溶液的pH为13,工业上制备r和q的反应如图所示,下列说法正确的是( )| A. | 单质的沸点:W>X | |
| B. | 简单离子半径:Z>Y>X | |
| C. | W与其他3种元素均能形成共价化合物 | |
| D. | X与其他3种元素均可形成至少两种二元化合物 |
| A. | K+、Cu2+、SO42-、Cl- | B. | Ca2+、Na+、CO32-、NO3- | ||
| C. | Na+、K+、Cl-、MnO4- | D. | Na+、Ba2+、Cl-、NO3- |
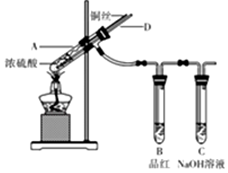 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示: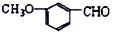 含有的官能团是醚键、醛基(填名称);它有多种同分异构体,其中属于酯且含有苯环结构的共有6种.
含有的官能团是醚键、醛基(填名称);它有多种同分异构体,其中属于酯且含有苯环结构的共有6种.