题目内容
32.64g铜和一定浓度的硝酸反应,铜完全溶解产生NO和NO2的混合气体在标准状况下的体积为11.2L,求生成的NO和NO2的物质的量.
32.64g铜的物质的量为
=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,
11.2L混合气体的物质的量为
=0.5mol,
设混合气体中含有xmolNO,ymolNO2,
则
解之得:
答:生成的NO和NO2的物质的量分别为0.26mol、0.24mol.
| 32.64g |
| 64g/mol |
11.2L混合气体的物质的量为
| 11.2L |
| 22.4L/mol |
设混合气体中含有xmolNO,ymolNO2,
则
|
解之得:
|
答:生成的NO和NO2的物质的量分别为0.26mol、0.24mol.

练习册系列答案
相关题目
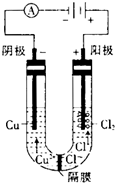 如图为细菌冶铜和火法冶铜的主要流程.
如图为细菌冶铜和火法冶铜的主要流程.