题目内容
32.64g铜和一定浓度的硝酸反应,铜完全溶解产生NO和NO2的混合气体在标准状况下的体积为11.2L,求生成的NO和NO2的物质的量.
【答案】分析:根据氧化还原反应转移的电子的物质的量守恒,结合气体的总体积列式计算.
解答:解:32.64g铜的物质的量为 =0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,
=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,
11.2L混合气体的物质的量为 =0.5mol,
=0.5mol,
设混合气体中含有xmolNO,ymolNO2,
则
解之得:
答:生成的NO和NO2的物质的量分别为0.26mol、0.24mol.
点评:本题考查化学方程式的计算,题目难度不大,注意从守恒的角度解答.
解答:解:32.64g铜的物质的量为
 =0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,
=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,11.2L混合气体的物质的量为
 =0.5mol,
=0.5mol,设混合气体中含有xmolNO,ymolNO2,
则

解之得:

答:生成的NO和NO2的物质的量分别为0.26mol、0.24mol.
点评:本题考查化学方程式的计算,题目难度不大,注意从守恒的角度解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
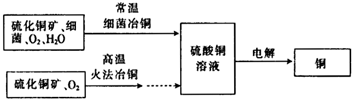
 如图为细菌冶铜和火法冶铜的主要流程.
如图为细菌冶铜和火法冶铜的主要流程.